Nature Medicine | 转移性结直肠癌治疗中,ctDNA基因改变作为生存期预后标志物的前瞻性分析
来源:生物探索 2024-02-17 10:38
研究发现,在ctDNA中未检测到预先定义的基因变异(即“负性超选”的患者,使用帕尼单抗治疗的总生存期较长。
发表于Nature Medicine的研究“Baseline ctDNA gene alterations as a biomarker of survival after panitumumab and chemotherapy in metastatic colorectal cancer”探讨了ctDNA基因变异作为转移性结直肠癌(mCRC)患者接受帕尼单抗和化疗后生存的生物标志物。
该研究基于PARADIGM试验,这是一项随机、开放标签的III期试验,旨在评估帕尼单抗加改良的5-氟尿嘧啶、亚叶酸钙、奥沙利铂(mFOLFOX6)与贝伐珠单抗(bevacizumab)加mFOLFOX6在未接受过化疗的RAS野生型mCRC患者中的疗效。研究发现,在ctDNA中未检测到预先定义的基因变异(即“负性超选”(negative hyperselected))的患者,使用帕尼单抗治疗的总生存期(median overall survival, OS)较长。这项研究的结果提供了使用ctDNA进行患者负性超选,以指导mCRC患者使用帕尼单抗治疗的潜在价值。

Highlights
负性超选(Negative Hyperselection)的应用:本研究利用循环肿瘤DNA(ctDNA)中的基因变异作为生物标志物,对患者进行负性超选,以预测转移性结直肠癌(mCRC)患者对帕尼单抗(panitumumab)加改良的FOLFOX6(mFOLFOX6)治疗的反应。这种策略有助于个性化患者治疗,选择最有可能受益的患者群体。
基因变异与治疗效果的关联:研究发现,那些在ctDNA检测中未发现特定基因变异的患者,使用帕尼单抗治疗后的总生存期(OS)显著延长。这表明ctDNA中的基因变异可以作为预测抗表皮生长因子受体(anti-EGFR)治疗效果的重要生物标志物。
大规模、多中心的III期试验数据:该研究基于PARADIGM试验,这是一个大规模、多中心的III期临床试验,提供了强有力的证据支持ctDNA在指导转移性结直肠癌治疗决策中的应用。
为未来的个性化治疗提供方向:通过对ctDNA中的多个基因变异进行分析,这项研究不仅在临床上具有应用潜力,而且还为未来研究提供了方向,可能进一步细化和优化针对特定遗传背景的mCRC患者的治疗策略。
推动液体活检(Liquid Biopsy)技术在癌症治疗中的应用:这项研究强调了液体活检在非侵入性检测癌症遗传信息,指导治疗决策中的重要作用,展现了其在未来癌症管理中的巨大潜力。
Strategies
患者群体选择:研究选取了参与PARADIGM试验、未接受过化疗的RAS野生型mCRC患者。这些患者被随机分配接受帕尼单抗加改良的5-氟尿嘧啶、亚叶酸钙、奥沙利铂(modified FOLFOX6, mFOLFOX6)治疗或贝伐珠单抗(bevacizumab)加mFOLFOX6治疗。
ctDNA检测:从患者的基线血浆样本中提取ctDNA,使用下一代测序(next-generation sequencing, NGS)技术检测ctDNA中的基因变异。研究聚焦于一组与抗EGFR治疗抵抗性相关的基因变异,包括KRAS、NRAS、PTEN、EGFR胞外域(extracellular domain, ECD)突变、HER2和MET扩增、ALK、RET和NTRK1融合。
负性超选策略(Negative Hyperselection Strategy):根据ctDNA检测结果,将患者分为两组——"负性超选"(没有检测到任何预先定义的抵抗性基因变异)和"基因变异"(检测到至少一种相关基因变异)。这一策略旨在识别最有可能从抗EGFR治疗中受益的患者群体。
临床结果分析:评估两组患者在接受帕尼单抗或贝伐珠单抗治疗后的总生存期(overall survival, OS)、无进展生存期(progression-free survival, PFS)、响应率(response rate)和治疗反应深度(depth of response)等临床结果。
Advancements
总生存期(Overall Survival, OS):在没有检测到预先定义的抗EGFR治疗抵抗性基因变异的“负性超选”(negative hyperselected)患者群体中,接受帕尼单抗加mFOLFOX6治疗的患者,其OS显著长于接受贝伐珠单抗(bevacizumab)加mFOLFOX6治疗的患者(中位数40.7个月对比34.4个月;风险比(hazard ratio, HR)为0.76;95%置信区间(confidence interval, CI)为0.62-0.92),但在ctDNA检测到任何基因变异的患者中,使用帕尼单抗治疗的OS与使用贝伐珠单抗治疗的OS相似或更短(中位数19.2个月对比22.2个月;HR为1.13;95% CI为0.83-1.53)。
无进展生存期(Progression-Free Survival, PFS):在“负性超选”的患者中,接受帕尼单抗治疗的PFS与接受贝伐珠单抗治疗的PFS相似,而在ctDNA检测到基因变异的患者群体中,接受帕尼单抗治疗的PFS可能更短。
响应率(Response Rate):在“负性超选”的患者中,接受帕尼单抗治疗的响应率高于接受贝伐珠单抗治疗的患者,尤其是在左侧原发性肿瘤(left-sided primary tumors)的患者中。
治疗反应深度(Depth of Response):在“负性超选”的患者中,接受帕尼单抗治疗的患者展现了更大的治疗反应深度,与接受贝伐珠单抗治疗的患者相比。
基因变异的频率和种类:在“负性超选”的患者中,左侧原发性肿瘤的患者满足负性超选标准的比率高于右侧原发性肿瘤(right-sided primary tumors)的患者。最常见的基因变异包括BRAF V600E突变、KRAS突变和PTEN突变。
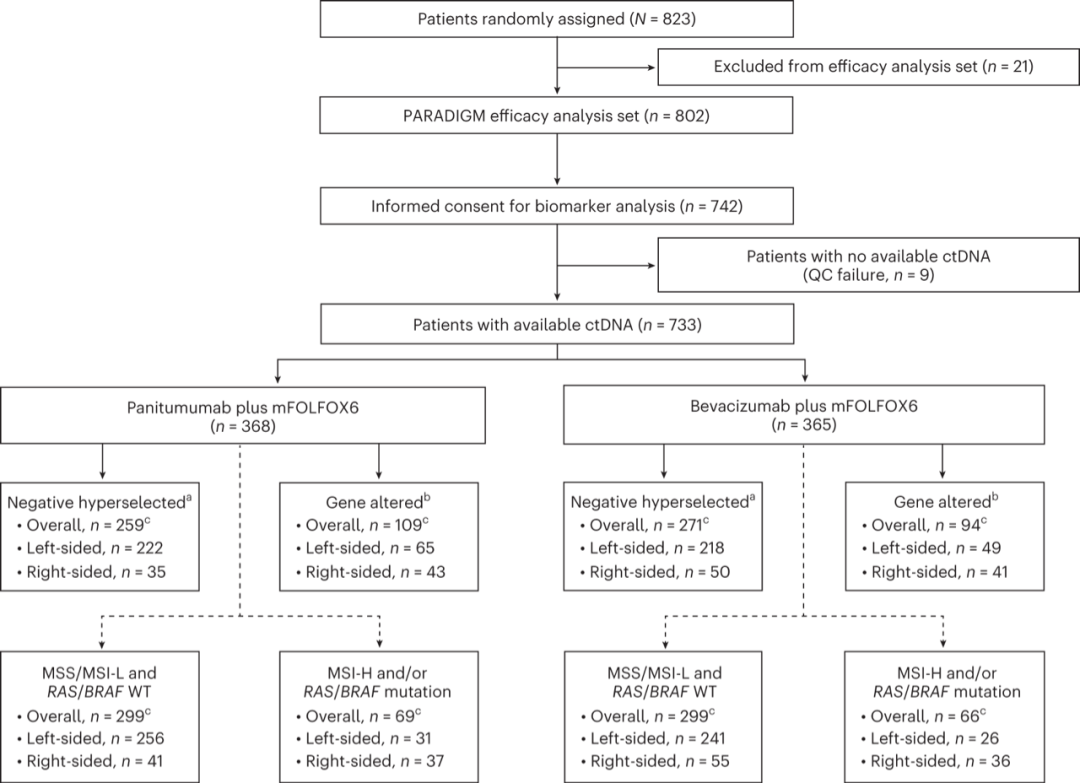
患者基因变异状态分析流程图(Credit: Nature Medicine)
Prospects
基因变异的全面性:该研究聚焦于特定的基因变异与抗EGFR治疗的关系,但mCRC的遗传异质性很高,还有其他潜在的基因变异可能影响治疗效果。这些未被包括在当前研究中的基因变异如何影响治疗选择和患者预后,仍需进一步探究。
长期生存和生活质量:研究主要关注总生存期(OS)和无进展生存期(PFS)等量化指标,对于治疗对患者生活质量的长期影响,以及如何通过个性化治疗方案改善患者的生活质量,这些问题还需要更多的研究来解答。
ctDNA检测的敏感性和特异性:尽管ctDNA作为一种非侵入性的生物标志物具有巨大潜力,但其检测的敏感性和特异性,尤其是在低突变负荷的情况下,仍是一个挑战。如何优化ctDNA检测技术以提高其在临床实践中的应用价值,需要进一步研究。
个体化治疗策略:该研究提出了基于ctDNA分析的负性超选策略,但如何将这一策略与其他临床参数和生物标志物结合,以进一步细化和优化mCRC的个体化治疗方案,还需要更多的研究。
经济性评估:ctDNA检测和基于此的个性化治疗策略在提高治疗效果的同时,其成本效益比如何,对于医疗系统的可行性和经济负担,仍需进行深入分析。
治疗抵抗机制:对于那些最初对治疗有反应但随后发展出治疗抵抗的患者,其背后的机制是什么,以及如何通过调整治疗策略来克服这些抵抗,这些问题对于延长患者生存时间至关重要。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


