打破癌细胞的能量工厂!Nat Metabol:科学家发现特殊的酶类阻滞或能抑制肝癌的生长
来源:生物谷原创 2025-02-12 11:48
本文研究结果表明,通过靶向作用醛缩酶A的功能来有到糖酵解不平衡或许能作为克服癌细胞固有代谢可塑性的一种独特的机会。
糖酵解(glycolysis)是细胞从糖中获取能量的主要代谢途径。长久以来,科学家们认为癌细胞主要依赖糖酵解来获得能量,这一现象被称为沃伯格效应(Warburg effect)。然而,最新的研究表明,癌细胞比我们想象的更加灵活,即使在糖酵解被阻断的情况下,它们也能通过呼吸链获取能量而生存。
近日,一篇发表在国际杂志Nature Metabolism上题为“Targeting aldolase A in hepatocellular carcinoma leads to imbalanced glycolysis and energy stress due to uncontrolled FBP accumulation”揭示了一个令人兴奋的新发现。德国癌症研究中心的研究团队发现,当阻断一种名为醛缩酶A(aldolase A)的酶的功能时——这种酶参与了糖酵解过程中的关键步骤——肝癌细胞会经历所谓的“能量压力”,停止分裂活动。研究人员不仅在小鼠肝癌细胞中验证了这一点,还在多种人类癌细胞系中得到了相同的结果。
有趣的是,当研究人员尝试阻断糖酵解早期阶段的一个步骤——即葡萄糖-6-磷酸异构酶的作用时,这对癌细胞的生长似乎并没有影响。Schulze博士解释道,“虽然糖酵解路径本身不是必须的,但糖酵解酶醛缩酶对肝癌细胞来说却是不可或缺的。”这听起来可能有些矛盾,因为通常情况下,阻止这些酶应该会抑制糖类的降解。
然而,深入探究糖酵解的生化步骤后,科学家们发现这条代谢路径可以分为两个部分:首先,细胞需要投入能量生成高能中间产物果糖-1,6-二磷酸(fructose bisphosphate)。醛缩酶A在这个过程中扮演着独特且易受影响的角色,无论肿瘤的基因型或环境条件如何。
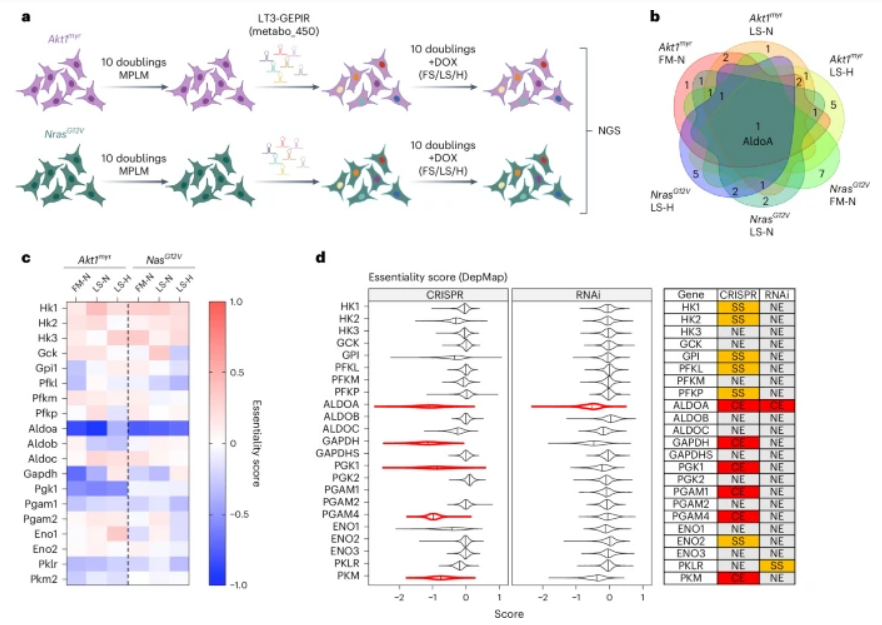
ALDOA能在糖酵解过程中表现出独特的易感性,且与肿瘤基因型和环境条件无关
如果醛缩酶A被关闭,果糖-1,6-二磷酸就会在细胞内堆积,其中储存的能量无法被利用。这意味着细胞不能继续进行正常的能量获取步骤,反而使糖酵解从一个产生能量的过程变成了消耗能量的过程。更糟糕的是,缺乏能量会进一步刺激果糖-1,6-二磷酸的生成,形成恶性循环,最终导致能量消耗超过能量生产。对于肝癌细胞而言,这会导致严重的能量短缺、细胞周期停滞以及肿瘤生长受到抑制。
Snaebjornsson教授补充说:“通过关闭醛缩酶A的功能,我们不仅能阻断糖酵解产生的能量,还能阻止细胞转向其他代谢途径,因为能量被困在果糖-1,6-二磷酸中。”因此,靶向抑制醛缩酶A或许成为了一种对抗癌细胞的新策略。尽管目前可用的醛缩酶A抑制剂仅限于实验用途,尚未作为药物批准使用,但研究人员正在测试其作为癌症治疗的潜力。
值得注意的是,即使只是轻微降低醛缩酶A的活性也足以让癌细胞陷入“能量陷阱”。正常细胞由于摄入的葡萄糖较少,产生的富含能量的果糖-1,6-二磷酸也相对较少,因此能够承受这种情况。换句话说,沃伯格效应成为了癌细胞的一个致命弱点,使其对醛缩酶A的阻滞变得敏感。深入理解肿瘤代谢有望为开发创新性癌症治疗方法铺平道路,特别是那些能够针对癌细胞代谢弱点而不损害健康细胞的疗法。
总之,这项研究表明,通过靶向醛缩酶A以诱导糖酵解失衡,可能是克服癌细胞内在代谢灵活性的独特机会。(生物谷Bioon.com)
参考文献:
Snaebjornsson, M.T., Poeller, P., Komkova, D. et al. Targeting aldolase A in hepatocellular carcinoma leads to imbalanced glycolysis and energy stress due to uncontrolled FBP accumulation. Nat Metab (2025). doi:10.1038/s42255-024-01201-w
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


