研究揭示染色质重塑因子Smarca5促进胚胎期造血干祖细胞发育
来源:动物所 2020-08-11 12:26
造血作用可以产生所有类型的血细胞,包括红细胞、血小板、巨噬细胞和淋巴细胞等。这些血细胞来源于具有自我更新和多向分化潜能的造血干祖细胞(hematopoietic stem and progenitor cells,HSPCs)。脊椎动物中,最早的新生造血干祖细胞,是由主动脉-性腺-中肾区(aorta-gonad-mesonephros,AGM)的
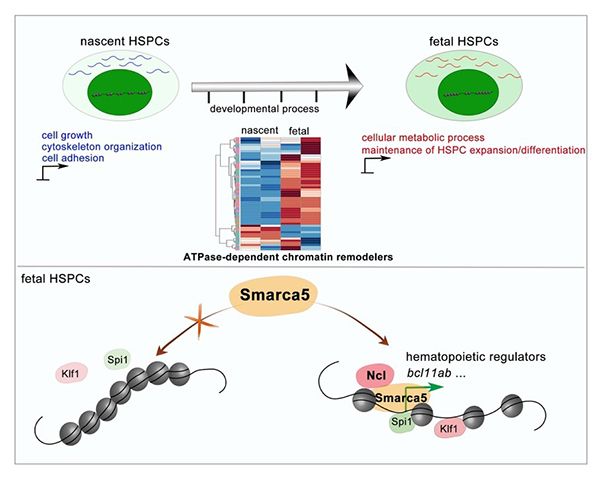
造血作用可以产生所有类型的血细胞,包括红细胞、血小板、巨噬细胞和淋巴细胞等。这些血细胞来源于具有自我更新和多向分化潜能的造血干祖细胞(hematopoietic stem and progenitor cells,HSPCs)。脊椎动物中,最早的新生造血干祖细胞,是由主动脉-性腺-中肾区(aorta-gonad-mesonephros,AGM)的动脉腹侧的生血内皮经过内皮-造血转化过程产生的。造血干祖细胞迁移到哺乳动物的胎肝(fetal liver,FL)或斑马鱼的尾部造血组织 (caudal hematopoietic tissue,CHT)进行快速扩增和分化。研究发现,小鼠中AGM区刚产生的造血干祖细胞处于非成熟状态,迁移到胎肝后,才能完全获得造血相关的转录组特性。此外,AGM和胎肝中的造血干祖细胞的移植重建能力不同:AGM区产生的造血干细胞对免疫排斥更加敏感,只有移植到新生小鼠中才能进行移植重建。因此,研究各个造血组织中,处于不同发育阶段的造血干祖细胞,比较其染色质开放状态及基因调控差异,将为体外诱导获得具有较好移植重建能力的造血干祖细胞提供理论指导。
8月5日,中国科学院动物研究所研究员刘峰团队与同济大学教授张勇团队合作,在BLOOD上发表了题为Smarca5 mediated epigenetic programming facilitates fetal hematopoietic stem and progenitor cell development in vertebrates的研究论文。研究发现,在产生和扩增/分化等不同发育阶段的造血干祖细胞中,染色质可接近性和转录组存在动态变化。深入机制探索发现,染色质重塑因子Smarca5通过与核仁蛋白Nucleolin相互作用,促进染色质重塑,调控造血相关的转录因子与基因组结合,进而促进造血干祖细胞发育。
研究人员利用模式动物斑马鱼,聚焦染色质可接近性和转录组,研究胚胎期两个造血组织中造血干祖细胞的基因表达动态调控。通过对斑马鱼AGM区新产生的造血干祖细胞以及处于扩增/分化阶段的CHT区造血干祖细胞进行ATAC-seq和 RNA-seq分析,发现染色质开放性在AGM区和CHT区造血干祖细胞中存在动态变化,启动子区的染色质开放程度对于基因的转录影响更为明显。与AGM区新生造血干祖细胞相比,造血相关基因的染色质开放性在CHT区造血干祖细胞中更加富集。同时,造血相关基因的表达水平在CHT区造血干祖细胞中更高。以上结果暗示,CHT区造血干祖细胞具有更加稳定和特异的造血能力。
为了寻找调控造血干祖细胞发育过程中染色质状态变化的关键染色质重塑因子,研究人员结合染色质重塑因子在AGM区和CHT区造血干祖细胞中的表达以及基因敲低/敲除实验,证实Smarca5通过调节染色质可接近性促进CHT区造血干祖细胞的增殖和分化。此外,通过质谱检测和功能性实验验证,研究人员发现核仁蛋白Nucleolin可以与Smarca5相互作用,并调控CHT区造血干祖细胞扩增/分化。进一步机制研究证明,Nucleolin有助于Smarca5介导的染色质重塑,进而影响与造血干祖细胞增殖和分化相关的转录因子(包括:Klf1和Spi1)与基因组的结合。如Smarca5缺失影响了Spi1在bcl11ab启动子区的结合,导致bcl11ab表达下调, 进而造成CHT区造血干祖细胞发育缺陷。
该研究揭示了表观遗传调控在各造血组织中不同阶段的造血干祖细胞发育的重要性。研究工作受到国家重点研发计划、国家自然科学基金以及中科院的资助。 (生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


