JITC:郑大一附院团队发现,髓源免疫抑制细胞会加速杀伤性T细胞的衰老!
来源:奇点糕 2023-12-21 10:34
这次研究补全的GPR84+MDSCs免疫抑制证据链,无疑为临床干预提供了新的机遇,未来的针对性疗法不仅可以靶向GPR进行拮抗,还可以将GPR84+MDSCs介导免疫抑制的外泌体作为靶点,斩断它们压制C
近日,郑州大学第一附属医院张毅团队在Journal of ImmunoTherapy of Cancer期刊发表的论文,就揭示了一类特征为表达G蛋白偶联受体84(GPR84+)、免疫抑制性极强MDSCs的“犯罪过程”:这部分MDSCs可以把GPR84经外泌体递送给CD8+T细胞,进而激活CD8+T细胞的p53信号通路,让这些抗癌主力进入衰老状态,简直是防不胜防的损招啊。

论文首页截图
在今年早些时候发布的另一篇论文中,张毅团队已经揭示了GPR84是MDSCs的“专属标记”,且与接受免疫治疗的食管癌患者不良预后相关,这可能是因为GPR84影响了肿瘤微环境内的PD-L1表达水平;而拮抗GPR84则能够正向重塑免疫微环境,与免疫治疗实现协同增效,算是找到了靶向MDSCs的一条新路。
但故事还没有讲完整,因为影响PD-L1表达似乎不足以完全解释GPR84+MDSCs极强的免疫抑制性,它们还有什么别的招数呢?带着这个疑问,研究团队开始评估GPR84+MDSCs与肿瘤微环境中T细胞的相互作用,既往已经有许多研究显示,MDSCs可以通过与T细胞直接或间接的相互作用来抑制T细胞,GPR84+MDSCs也是如此吗?
实验显示,将CD8+T细胞与GPR84+MDSCs共培养后,伴随着CD8+T细胞的增殖能力和抗肿瘤活性明显减弱,CD8+T细胞中表达GPR84的比例也同步上升,乃至出现了明显的耗竭特征;而使CD8+T细胞过表达GPR84,就能在不需要MDSCs介入的状态下,诱导非常相似的免疫抑制效应,直接敲除GPR84则会大幅增强CD8+T细胞的战斗力。
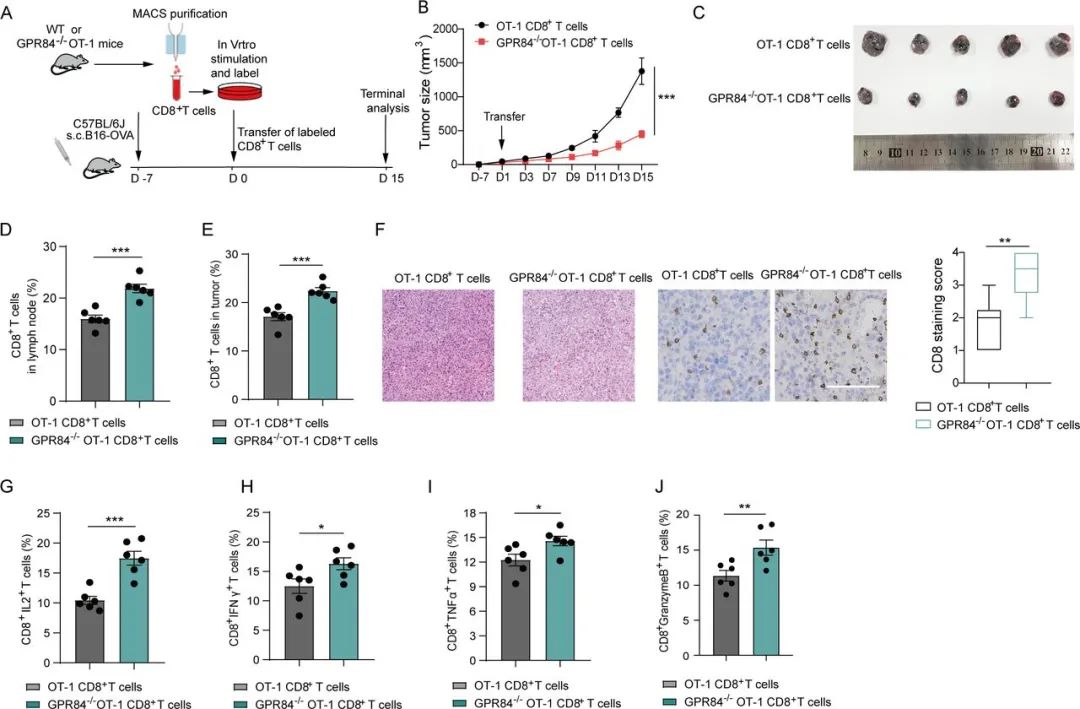
GPR84水平对CD8+T细胞的影响
研究团队由此推测,CD8+T细胞的GPR84水平上升是导致免疫抑制的重要环节,并通过实验证实,这些GPR84确实是来自MDSCs:在共培养前后,CD8+T细胞内的GPR84 mRNA水平并无显著变化,即排除了MDSCs诱导CD8+T细胞自身合成GPR84的可能性,而GPR84的传递是通过外泌体实现的,CD8+T细胞接收到的是已合成完毕的GPR84蛋白。
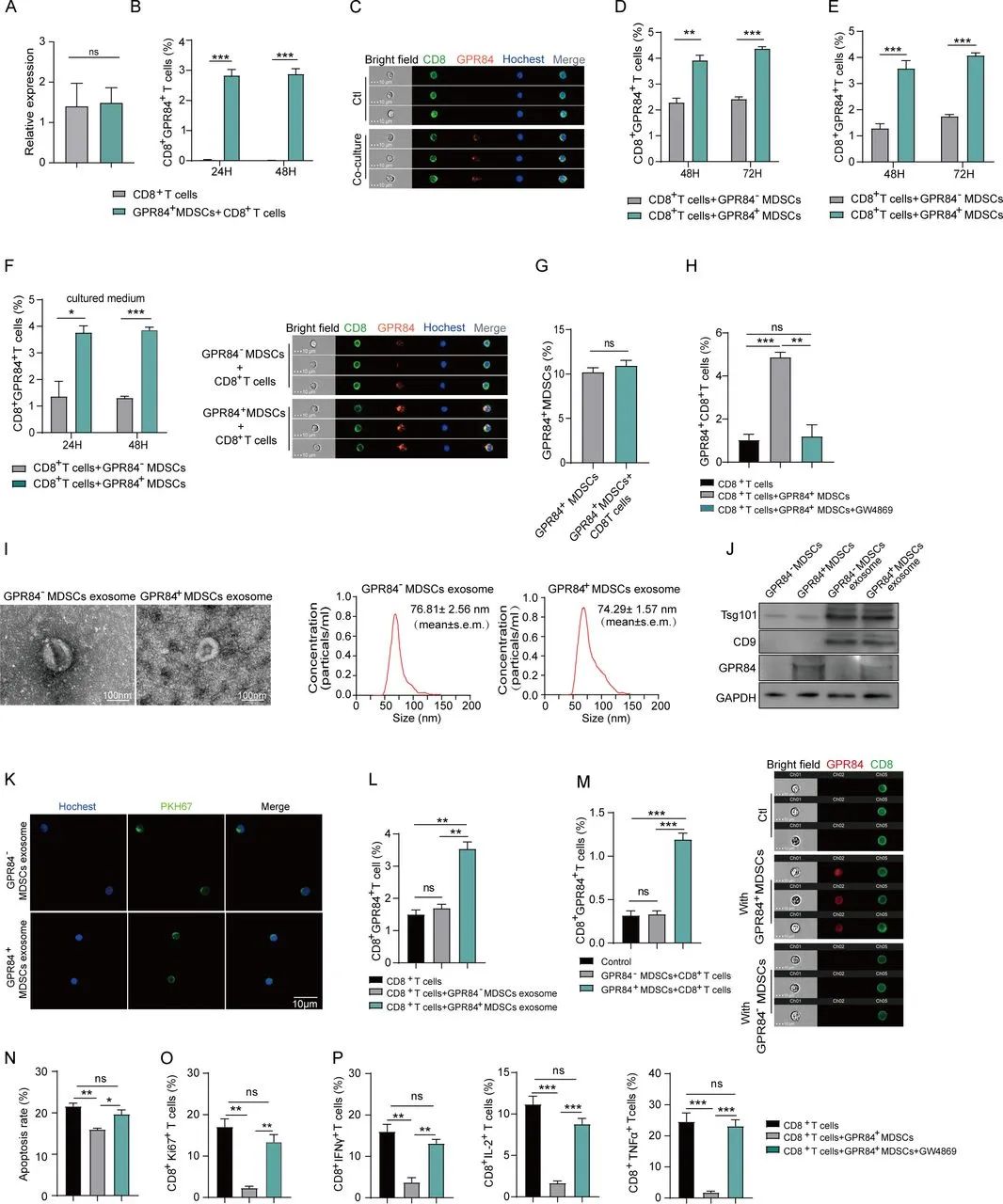
MDSCs通过外泌体向CD8+T细胞传递GPR84
对CD8+T细胞的基因表达分析显示,收到外泌体中的GPR84后,CD8+T细胞中表达上调和富集的主要是p53信号通路,这会使CD8+T细胞进入衰老状态,特征是细胞表面CD27、CD28表达阴性,而CD57、KLRG1表达阳性,且衰老标志物β-半乳糖苷酶(SA-β-Gal)染色阳性,CD8+T细胞甚至还出现了端粒长度的明显缩短。
而在p53基因敲除(Trp53–/–)小鼠中,与MDSCs共培养的CD8+T细胞就不会被诱导进入衰老状态,证实了p53信号通路的关键作用,而导致衰老相关损伤的还有GPR84+MDSCs大量生成的活性氧(ROS),ROS会与p53信号通路共同激活DNA损伤通路导致免疫抑制,甚至直接要了CD8+T细胞的小命。
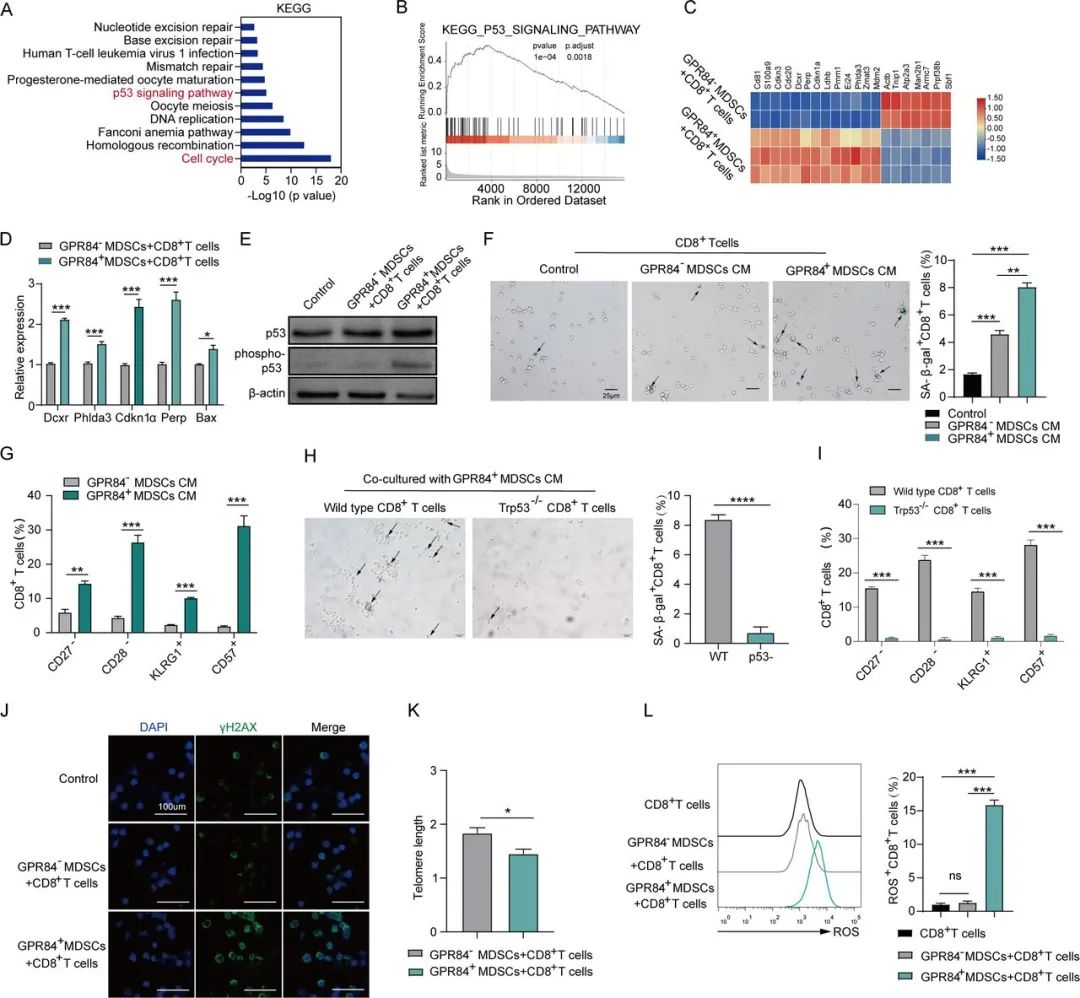
GPR84+MDSCs激活p53通路,使CD8+T细胞进入衰老状态
最后就是用外部数据,初步证实GPR84+MDSCs在人类癌症患者中的作用了:来自癌症基因组图谱计划(TCGA)的数据显示,肺腺癌/鳞癌及皮肤黑色素瘤中的GPR84表达水平,均与CD8+T细胞浸润程度和患者生存呈负相关,但GPR84+CD8+T细胞与GPR84+MDSCs的水平呈正相关,这就和前面的细胞共培养实验完全吻合了;此外,GPR84+CD8+T细胞还多见于化疗耐药患者,针对GPR84+MDSCs还可能破解耐药。
这次研究补全的GPR84+MDSCs免疫抑制证据链,无疑为临床干预提供了新的机遇,未来的针对性疗法不仅可以靶向GPR进行拮抗,还可以将GPR84+MDSCs介导免疫抑制的外泌体作为靶点,斩断它们压制CD8+T细胞的黑手。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


