Cell Host & Microbe:高脂肪饮食可破坏肠道微生态平衡,导致代谢功能障碍
来源:生物谷原创 2022-04-21 19:37
生物节律的协调主要受饮食和宿主与微生物成分之间相互感应效应信号的影响,最终驱动新陈代谢。恢复肠道微生物群感知由特定宿主因素(如Reg3γ)介导的饮食信号的能力,可以用来改善代谢功能紊乱。
现代社会昼夜节律的破坏导致代谢疾病发病率上升。昼夜节律是行为和生物过程中的24小时振荡,部分由在体内几乎所有细胞中发现的核心生物钟(CC)转录 - 翻译反馈回路驱动,对于调节主要代谢和免疫途径至关重要。当昼夜节律改变或无功能时,会出现不良代谢后果,包括肥胖增加和胰岛素敏感性受损。研究表明,数万亿的肠道微生物不仅影响宿主的消化,吸收和能量平衡,而且还与宿主CC错综复杂地交织在一起,其中通过环境操纵高脂肪(HF)饮食,或通过基因突变导致肠道微生物组振荡的丧失。肠道微生物昼夜振荡是宿主昼夜节律和新陈代谢的重要饮食依赖驱动因素,可确保最佳的能量平衡。然而,饮食、微生物和维持肠道振荡的宿主因素之间的相互作用是复杂的,并且知之甚少。
与宿主 - 微生物昼夜模式相关的一个特定AMP是再生胰岛衍生的蛋白质3γ(Reg3γ)。近日,发表在Cell Host & Microbe上的一篇题为“Western diet disrupts reg3γ and gut microbial rhythms promoting metabolic dysfunction. Social Science Electronic Publishing”的学术论文研究了来自特定肠道细菌的信号是否需要驱动Reg3γ的宿主昼夜表达模式,以及这些内源性线索是否可以“重置”细菌振荡,以确定微生物信号是否在HF饮食诱导的肠道生态失调中丢失,进一步加剧了宿主代谢紊乱。

在本研究中,研究人员使用小鼠模型,发现远端SI Reg3γ昼夜表达不在CC控制下,而是由特定的,饮食依赖性振荡细菌局部调节。宿主C型凝集素抗菌肽Reg3γ与关键的回肠微生物以双向的方式协调这些互动,并且与肠道核心生物钟不相关。此外,来自普通饲料饮食所促进的细菌的小分子,而不是高脂肪(HF)饮食,在体外诱导Reg3γ的表达,并且这些细菌对REG3γ的抗菌作用表现出独特的抵抗力。最后,Reg3γ的缺乏加上高脂肪饮食使通常对REG3γ易感的特定肠道微生物的相对丰度获得震荡。因此,高脂肪饮食是损害宿主代谢平衡的微生物振荡器的主要驱动力,导致宿主Reg3γ表达失调,其次驱动关键肠道微生物的丰度和振荡。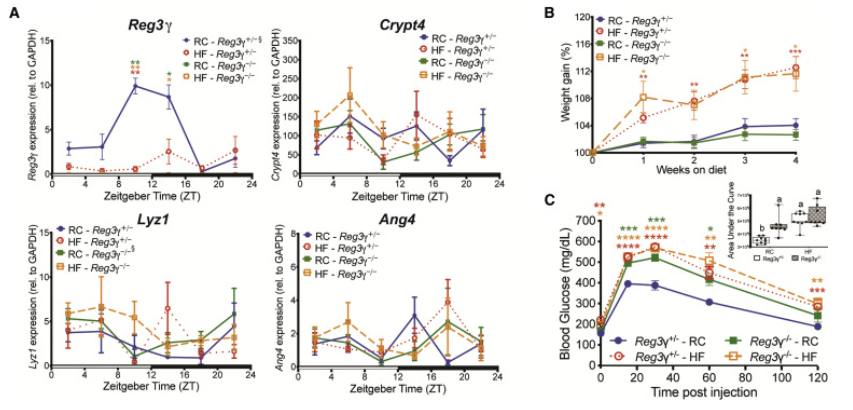
图 Reg3γ缺乏症以饮食依赖性方式影响葡萄糖稳态
总之,这项研究表明,生物节律的协调主要受饮食和宿主与微生物成分之间相互感应效应信号的影响,最终驱动新陈代谢。恢复肠道微生物群感知由特定宿主因素(如Reg3γ)介导的饮食信号的能力,可以用来改善代谢功能紊乱。
参考文献:Frazier, K. , Kambal, A. , Zale, E. A. , Pierre, J. F. , Hubert, N. , & Miyoshi, S. , et al. Western diet disrupts reg3γ and gut microbial rhythms promoting metabolic dysfunction. Social Science Electronic Publishing. https://doi.org/10.1016/j.chom.2022.03.030
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


