The Journal Of Allergy And Clinical Immunlolgy:在阿司匹林加重的呼吸系统疾病中,先天免疫细胞失调导致炎症和疾病
来源:生物谷 2021-08-22 23:20
阿司匹林加重性呼吸系统疾病(AERD)是一种复杂的炎症性疾病,通常不被视为涉及适应性免疫系统的疾病,而是一种主要由先天免疫系统驱动的疾病。本文研究者重点关注粘膜下层隔室中的细胞失调,特别是过度表达和失调的4种中央细胞类型:嗜酸性粒细胞,嗜碱性粒细胞,肥大细胞(MC)和先天淋巴样2型细胞 (ILC2)。
阿司匹林加重性呼吸系统疾病(AERD)是一种复杂的炎症性疾病,通常不被视为涉及适应性免疫系统的疾病,而是一种主要由先天免疫系统驱动的疾病。AERD可以被设想为涉及一个自我延续的恶性循环,其中由分化的活化上皮层产生的介质,如人白细胞介素25、33(IL-25、IL-33)和胸腺基质淋巴细胞生成素(TSLP) ,参与并激活这些先天免疫细胞。这些先天免疫细胞的激活及其产生额外的细胞因子/趋化因子和脂质介质导致这些先天免疫细胞的进一步募集和激活,此外,这些先天免疫细胞产生的大量介质会刺激上皮细胞进一步引发炎症。
图片来源:https://doi.org/10.1016/j.jaci.2021.06.016
这种自我延续的炎症循环部分解释了目前建议改善AERD的两种干预措施(例如,阿司匹林脱敏、白三烯调节剂、抗IL-5/IL-5受体、抗IL-4受体和抗IgE)并探索新靶点作为该病症的特异性疗法(前列腺素D2拮抗剂或细胞因子拮抗剂[IL-25、IL-33和TSLP生成素]),研究者重点关注粘膜下层隔室中的细胞失调,特别是过度表达和失调的4种中央细胞类型:嗜酸性粒细胞,嗜碱性粒细胞,肥大细胞(MC)和先天淋巴样2型细胞 (ILC2)。
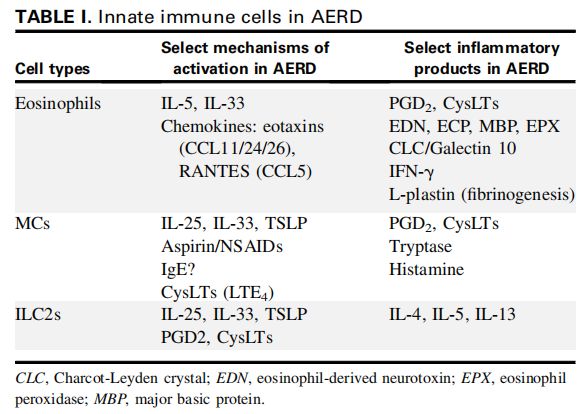
AERD中的先天免疫细胞 图片来源:https://doi.org/10.1016/j.jaci.2021.06.016
细胞嗜酸性粒细胞是与各种特应性和非特应性病症相关的强效2型炎性粒细胞,在AERD中,与健康气道组织相比,增生性鼻窦、鼻息肉(NP)和下气道中的嗜酸性粒细胞显着升高,AERD患者的嗜酸性粒细胞升高,通常可作为预测更严重鼻窦疾病的生物标志物。嗜碱性粒细胞是另一种有效的粒细胞亚群,在各种2型呼吸系统疾病中很重要,相比于NPs慢性鼻窦炎(CRSwNP)患者,AERD患者的NPs和外周血中的嗜碱性粒细胞均升高。
在本研究中,AERD和CRSwNP中的嗜碱性粒细胞同样被激活,这可以从它们的分化群63(CD63)表面表达强度看出,然而,通过细胞内2D7+粒中损失NP嗜碱性粒细胞可以看出,AERD显示出比CRSwNP更广泛的脱粒作用。嗜碱性粒细胞中2D7+表达的缺失与整个鼻窦疾病的严重程度有显著相关性,此外,对AERD患者鼻腔灌洗样本中的微粒(从激活或损伤的细胞释放的亚微米大小的脱落膜泡)的分析表明,AERD患者的嗜碱性粒细胞、MCs和血小板比CRS患者更活跃,这些发现表明嗜碱性粒细胞可能是AERD发病机制的另一个重要因素。
大量的观察表明,MCs在AERD的发病机制中起着核心作用,然而,AERD中MC激活的机制是复杂的,可能是由依赖于IgE和独立于IgE的机制介导的。AERD患者NPs中的IgE水平高于阿司匹林耐受个体,包括Fc ε RI结合IgE(在MCs、嗜碱性粒细胞和其他细胞上),这也证明了IgE是在AERD组织中新合成,而息肉组织中IgE水平与术后NP复发速度有直接关系,进一步支持局部IgE参与AERD发病机制的观点。除IgE外,AERD中MC的激活还涉及许多于IgE无关的机制,其中一种机制反映了阿司匹林和非甾体抗炎药本身直接刺激MCs启动脱粒和花生四烯酸代谢途径。此外,MCs上发现的抗炎EP2受体PGE2信号的减少对AERD中MC的激活很重要,非甾体抗炎药可减少炎症细胞中PGE2的产生和释放,与在AERD中观察到的EP2表达的基线下降相结合,PGE2的下降,响应非甾体抗炎药的摄入,释放了PGE2/EP2信号提供的限制,并快速驱动MC和嗜酸性粒细胞的激活。
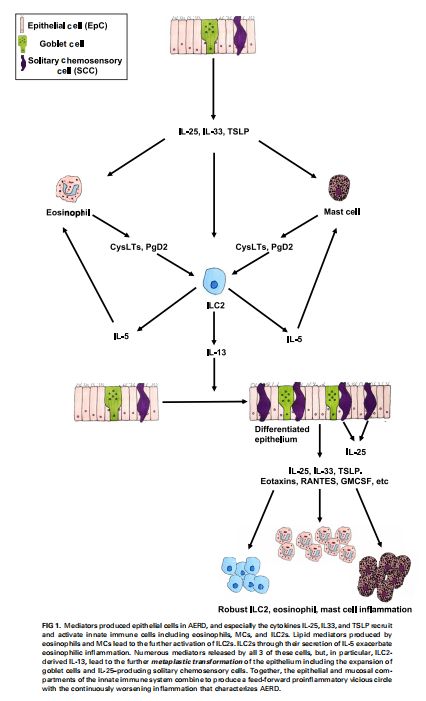
AERD的一种前馈促炎恶性循环 图片来源:https://doi.org/10.1016/j.jaci.2021.06.016
ILC2s是缺乏T细胞受体的淋巴细胞亚群,具有类似转录因子和细胞因子的适应性TH2细胞的天然对应物,可被脂质介质(包括PGD2和CysLTs)以及被称为“alarmins”的先天细胞因子(包括IL-33、IL-25和TSLP)激活。气道ILC2s被招募到AERD患者的气道中并受到脂质和细胞因子的调节,而脂质和细胞因子是AERD发病的关键,与适应性CD4+TH2细胞类似,ILC2s表达转录调节因子GATA-3,受到刺激时产生IL-4、IL-5和IL-13,导致组织嗜酸性粒细胞增多、粘液生成、气道高反应性,并促进适应性TH2和IgE反应。在AERD中发现的异常脂质和上皮细胞因子通路激活可能共同促进ILC2反应和2型炎症反应,在炎症条件下,包括在AERD中COX-1抑制剂的作用下,ILC2s的迁移增加,特别是在哮喘和过敏患者中,ILC2细胞对PGD2的体外趋化性增强,并依赖于CRTH2的表达。CysLTs和较少的IL-25和IL-33也可诱导人ILC2在体外的迁移,这可能与ILC2在AERD中的转运有关。
许多用于AERD治疗机制的疗法都是针对ILC2s的,但单独的一种细胞不可能负责AERD的发病机制,因此,针对任何单个免疫细胞的高度集中干预不太可能产生全面的疾病缓解。本文中讨论的模型解释了目前被证实或建议的具体改善AERD的干预措施(如阿司匹林脱敏、抗IL-5/IL-5R、抗IL - 4R和抗IgE),并寻找新的靶点作为这种疾病的特异性治疗方法(PGD2/CRTH拮抗剂或细胞因子拮抗剂[IL-25, IL-33, TSLP]),其中一些干预措施已经在小型回顾性分析中显示出了希望,现在需要明确的临床试验数据证明。(生物谷 bioon)
参考文献
Ryan Eid et al. Innate immune cell dysregulation drives inflammation and disease in aspirin-exacerbated respiratory disease. The Journal Of Allergy And Clinical Immunlolgy (2021 Aug 01) doi:https://doi.org/10.1016/j.jaci.2021.06.016
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



