中国结直肠癌患者福音!默克Erbitux(爱必妥)获批一线治疗RAS野生型转移性结直肠癌(mCRC)!
来源:本站原创 2019-09-29 16:41
2019年09月29日讯 /生物谷BIOON/ --德国制药巨头默克(Merck KGaA)近日宣布,中国国家药品监督管理局(NMPA)已批准抗癌药Erbitux(中文商品名:爱必妥,通用名:cetuximab,西妥昔单抗),联合FOLFOX(奥沙利铂+亚叶酸钙+5-氟尿嘧啶[5-FU])或FOLFIRI(伊立替康+亚叶酸钙+5-FU)一线治疗RAS野生型(wt)转移性结直肠癌(mCRC)患者、或

2019年09月29日讯 /生物谷BIOON/ --德国制药巨头默克(Merck KGaA)近日宣布,中国国家药品监督管理局(NMPA)已批准抗癌药Erbitux(中文商品名:爱必妥,通用名:cetuximab,西妥昔单抗),联合FOLFOX(奥沙利铂+亚叶酸钙+5-氟尿嘧啶[5-FU])或FOLFIRI(伊立替康+亚叶酸钙+5-FU)一线治疗RAS野生型(wt)转移性结直肠癌(mCRC)患者、或联合伊立替康(irinotecan)用于对伊立替康化疗无效的患者。
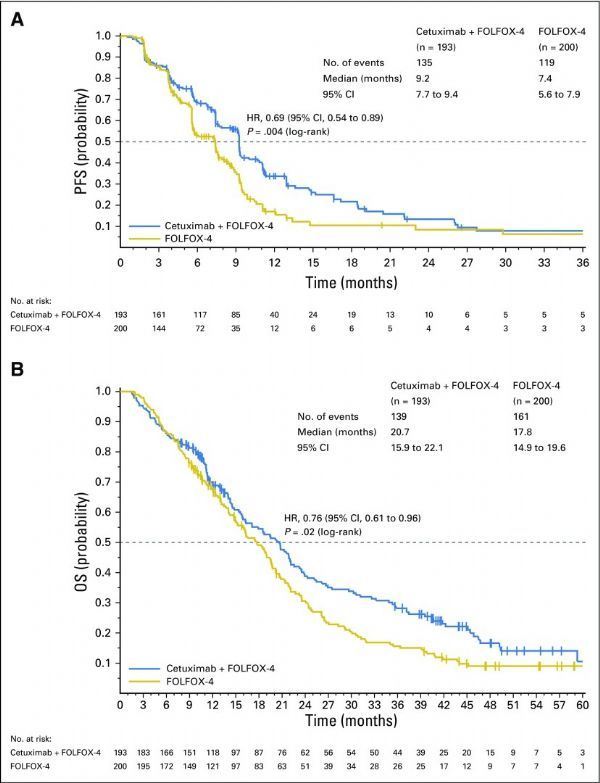
该批准基于关键性III期研究TAILOR(NCT01228734)的数据。这是一项随机研究,在改良意向治疗(mITT)人群中,来自中国的393例RAS wt mCRC患者以1:1的比例进入2个治疗组,一组接受FOLFOX治疗,另一组接受Erbitux与FOLFOX联合治疗,直至疾病进展、撤回同意(撤回同意书)、或不可接受的毒性。主要终点是无进展生存期(PFS),次要终点包括总生存期(OS)和总缓解率(ORR)。
结果显示,该研究达到了主要终点和全部次要终点,与FOLFOX相比,Erbitux与FOLFOX联合治疗在PFS、OS、ORR方面均表现出显著益处:(1)与FOLFOX治疗组相比,Erbitux与FOLFOX联合治疗组疾病无进展生存期显著延长(中位PFS:9.2个月 vs 7.4个月)、疾病进展或死亡风险降低31%(HR=0.69;95%CI:0.54-0.89,p=0.004);(2)与FOLFOX治疗组相比,Erbitux与FOLFOX联合治疗组生存期显著延长(中位OS:20.7个月 vs 17.8个月)、死亡风险降低24%(HR=0.76,95%CI:0.61-0.96,p=0.02);(3)与FOLFOX治疗组相比,Erbitux与FOLFOX联合治疗组总缓解率显著提高(ORR:61.1% vs 39.5%;比值比[OR]=2.41,95%CI:1.61-3.61,p<0.001)。研究中,Erbitux的耐受性良好,没有新的或意外的安全性发现。
根据默克发布的新闻稿,TAILOR研究是在中国患者群体中开展的首个III期临床研究,旨在前瞻性地评估一种抗EGFR抗体一线治疗RAS wt mCRC患者以及加强RAS生物标记物检测在临床实践中的价值和重要性,以便从开始治疗时为患者提供正确的靶向疗法。这些数据与之前公布的国际性关键研究的结果一致,再次确定了Erbitux与FOLFOX联合用药方案作为一种一线疗法对RAS wt mCRC患者的疗效。
TAILOR研究的首席调查员、上海同济大学附属东方医院肿瘤医学部主任李进教授表示:“长期以来,Erbitux联合化疗,一直是治疗RAS wt mCRC的一个标准护理方案,TAILOR研究进一步证明了该方案用于一线治疗的可能性。此次批准对中国患者而言标志着一个重大进步,这些患者现在有了一种新的、急需的治疗方案。”
默克国际业务和全球核心专营权负责人Chris Round表示:“Erbitux是全球公认的治疗RAS野生型mCRC的一线护理标准。我们非常高兴中国国家药品监督管理局(NMPA)批准Erbitux用于中国患者的一线治疗,此次批准是默克作为一家全球专业创新企业的承诺向前迈出的重要一步,包括将创新药物推向医疗需求未得到满足的市场。”
西妥昔单抗:首个靶向EGFR的单抗,已纳入国家医保目录
结直肠癌(CRC)是全球第三大常见癌症、第二大常见癌症死亡原因。据估计,全球每年新发病例超过185万例,每年估计有88万人死于CRC,占所有癌症死亡的9.2%。大约55%的CRC病例来自世界发达地区,男性中的发病率和死亡率大大高于女性。转移性CRC中,大约一半为RAS野生型肿瘤,一半是RAS突变型肿瘤。评估mCRC患者RAS突变状态的研究结果表明,抗表皮生长因子受体(EGFR)单克隆抗体疗法,如Erbitux(西妥昔单抗),可改善RAS野生型mCRC患者的预后。
Erbitux于2003年上市,是全球首个靶向EGFR的IgG1单克隆抗体。作为一种单抗药物,Erbitux与标准的非选择性化疗药物不同之处在于靶向并结合EGFR,这种结合抑制了受体的激活和之后的信号通路传导,减少了肿瘤细胞对正常组织的侵袭以及肿瘤向新位点的扩散。此外,Erbitux被认为也能够抑制肿瘤细胞修复化疗和放疗所致损伤的能力、以及抑制肿瘤内新生血管的形成,这似乎导致肿瘤生长的整体抑制。基于体外证据,Erbitux还能将细胞毒性免疫效应细胞导向表达EGFR的肿瘤细胞(抗体依赖性细胞介导的细胞毒性,ADCC)。临床治疗上,Erbitux最常见的副作用包括痤疮样皮疹、轻度至中度输液相关反应和低镁血症。
截至目前,Erbitux已获全球100多个国家批准,治疗RAS野生型转移性结直肠癌(RAS wt mCRC)和/或头颈部鳞状细胞癌(SCCHN)。Erbitux由ImClone(现为礼来全资子公司)研制,默克于1998年授权获得了Erbitux除美国和加拿大以外市场的独家权益。在欧盟,Erbitux适用于:(1)联合含奥沙利铂方案FOLFOX一线治疗RAS wt mCRC患者;(2)联合含伊立替康的方案,一线或多线治疗RAS wt mCRC患者;(3)作为一种单药疗法,用于接受含奥沙利铂方案或含伊立替康方案失败的RAS wt mCRC患者以及对伊立替康不耐受的RAS wt mCRC患者。
在中国,Erbitux于2006年获批治疗RAS基因野生型转移性结直肠癌(RAS wt mCRC)。Erbitux被纳入《国家基本医疗保险、工伤保险和生育保险药品目录((2017年版))》乙类范围。今年8月份,国家医保局和人力资源社会保障部发布《国家基本医疗保险、工伤保险和生育保险药品目录(2019年版)》,Erbitux属于协议期内谈判药品,医保支付标准为:1295元(100mg(20ml)/瓶),限定支付范围为:限RAS基因野生型的转移性结直肠癌(RAS wt mCRC)。
去年11月,默克公布了Erbitux与铂类化疗联合疗法(称为“EXTREME”方案)一线治疗中国的复发性和/或转移性头颈部鳞状细胞癌(R/M SCCHN)患者的III期研究CHANGE II的数据。结果显示,与铂类化疗相比,EXTREME方案延长了无进展生存期(中位PFS:5.5个月 vs 4.2个月,HR=0.57,95%CI:0.40-0.80)、延长了总生存期(中位OS:10.2个月 vs 8.4个月,HR=0.71,95%CI:0.50-0.99)、提高了总缓解率(ORR:50% vs 27%)。研究中没有观察到新的或意外的安全发现。
这些结果证实了EXTREME方案在这类患者群体中的疗效和安全性。根据该项研究结果,默克计划在中国提交申请,使中国的R/M SCCHN患者从EXTREME方案中获益。(生物谷Bioon.com)
原文出处:
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->