Nature:震惊!揭示哺乳动物大脑中的V-ATPase在两种不同状态之间转换新机制
来源:生物谷原创 2022-11-30 10:35
在一项新的研究中,研究人员在进一步了解哺乳动物大脑方面取得了新的突破,他们有了一个令人难以置信的发现:一种激活大脑信号的重要酶会随机地开启和关闭,甚至进行长达数小时的“休息时间”。
在一项新的研究中,来自丹麦哥本哈根大学的研究人员在进一步了解哺乳动物大脑方面取得了新的突破,他们有了一个令人难以置信的发现:一种激活大脑信号的重要酶会随机地开启和关闭,甚至进行长达数小时的“休息时间”。这些发现可能会对我们对大脑的理解和药物开发产生重大影响。相关研究结果发表在2022年11月24日的Nature期刊上,论文标题为“Regulation of the mammalian-brain V-ATPase through ultraslow mode-switching”。

数以百万计的神经元不断地相互传递信息,形成思想和记忆,让我们可以随心所欲地移动身体。当两个神经元相遇交换信息时,神经递质在一种独特的酶的帮助下从一个神经元运送到另一个神经元。
这一过程对于神经元沟通和所有复杂有机体的生存至关重要。在此之前,全世界的科学家们都认为这种酶在任何时候都是活跃的,以不断传递基本信号。但事实远非如此。
在这项新的研究中,这些作者利用一种创新的方法,对这种酶进行了仔细研究,发现它的活性以随机的时间间隔开启和关闭,这与我们以前的理解相矛盾。
论文通讯作者、哥本哈根大学化学系几何工程细胞系统中心的Dimitrios Stamou教授说,“这是第一次有人逐一研究哺乳动物大脑中的酶,我们对这一结果感到震惊。与流行的看法相反,而且与许多其他蛋白不同,这种酶可以停止工作几分钟到几小时。尽管如此,人类和其他哺乳动物的大脑还是奇迹般地能够发挥作用。”
在此之前,这类研究是用来自细菌的非常稳定的酶进行的。利用这种新方法,这些作者首次研究从大鼠大脑中分离出来的哺乳动物酶。
酶活性转换可能对神经元通信有深远的影响
神经元利用神经递质进行沟通。为了在两个神经元之间传递信息,神经递质首先被泵入突触小泡(synaptic vesicle)中。这些突触小泡作为容器储存神经递质,只有在传递信息的时候才在两个神经元之间释放它们。
这项新研究着重关注的核心酶被称为液泡型ATP酶(V-ATPase),负责为突触小泡中的神经递质泵提供能量。没有它,神经递质就不会被泵入突触小泡,而这些突触小泡就不能在神经元之间传递信息。
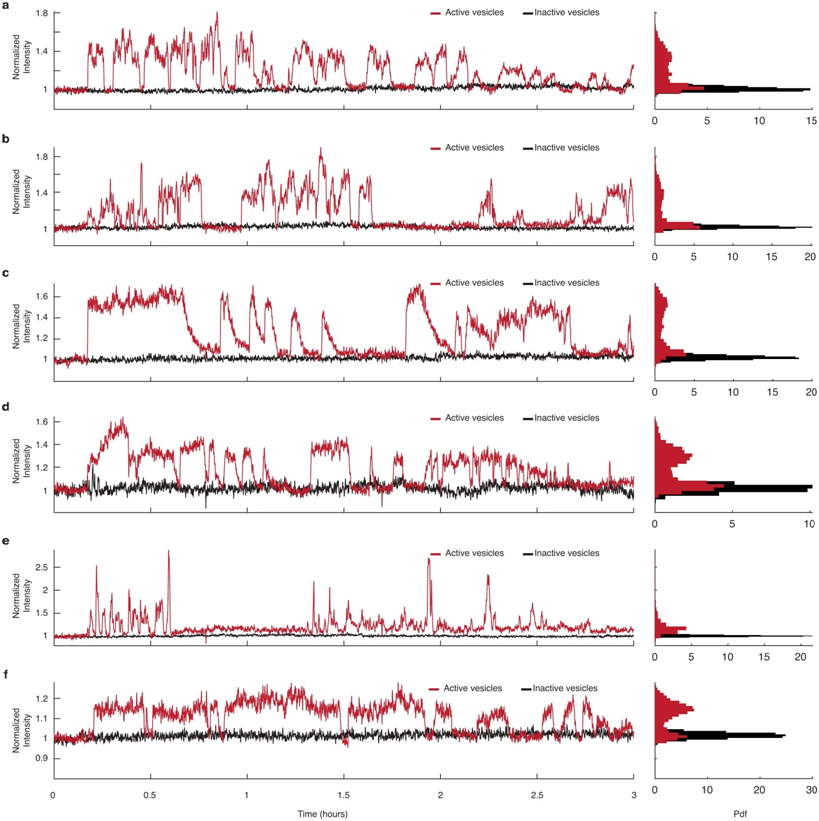
图片来自Nature, 2022, doi:10.1038/s41586-022-05472-9。
但是这项新的研究表明,在每个突触小泡中,只有一种酶;当这种酶关闭时,将没有更多的能量来驱动神经递质装入突触小泡。这是一个全新的、意想不到的发现。
Stamou教授说,“将神经递质装入突触小泡这一极其关键的过程仅被委托给每个突触小泡中的一种分子,这几乎是不可理解的。特别是当我们发现这些分子有40%的时间是关闭的时候。”
他说,这些发现提出了许多耐人寻味的问题:“关闭突触小泡的能量来源是否意味着许多突触小泡确实没有神经递质?大量空的突触小泡是否会对神经元之间的沟通产生重大影响?如果是这样,这是否会成为神经元进化后规避的一个‘问题’,或者它可能是大脑中重要信息编码的一种全新方式?只有时间会告诉答案。”
一种筛选针对V-ATPase的药物的革命性方法
V-ATPase是一种重要的药物靶标,因为它在癌症、癌症转移和其他一些威胁生命的疾病中起着关键作用。因此,V-ATPase是抗癌药物开发的一种有利可图的靶标。
现有的针对V-ATPase的药物筛选方法是基于同时对数十亿个酶的信号进行平均化。只要一种酶不断地及时工作,或者当酶大量地一起工作时,知道一种药物的平均效果就足够了。
论文第一作者、哥本哈根大学化学系的Elefterios Kosmidis博士说,“然而,我们现在知道对于V-ATPase来说,这两者都不一定正确。因此,拥有测量单个V-ATPase行为以便了解和优化药物的预期效果的方法突然变得至关重要。”
这项新研究开发的方法是有史以来第一种能够测量药物对单个V-ATPase分子的质子泵送影响的方法。它可以检测到比黄金标准的膜片钳方法小100万倍以上的电流。
关于V-ATPase的事实:(1)V-ATPase是分解ATP分子以泵送质子穿过细胞膜的酶;(2)它们存在于所有细胞中,对于控制细胞内部和/或外部的pH/酸度至关重要;(3)在神经元中,由V-ATPase建立的质子梯度为将称为神经递质的神经化学信使分子装入突触小泡以便随后在突触连接处释放它们提供能量。(生物谷 Bioon.com)
参考资料:
Eleftherios Kosmidis et al. Regulation of the mammalian-brain V-ATPase through ultraslow mode-switching, Nature, 2022, doi:10.1038/s41586-022-05472-9.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


