ACS Nano:李亚平团队构建三元协同纳米粒,攻破三阴性乳腺癌免疫抑制网络
来源:生物世界 2023-09-18 11:04
研究团队首先合成了pH敏感的两亲性聚(β-氨基酯)衍生物,并用其构建了共递送MDSC抑制剂恩替诺特(ENT)和PD-1/PD-L1抑制剂BMS-1的胶束(BEM)。
中国科学院上海药物研究所李亚平课题组在 ACS Nano 期刊发表了题为:Breaking tumor immunosuppressive network by regulating multiple nodes with triadic drug delivery nanoparticle 的研究论文。
该研究构建了具有级联酸敏感的三元协同纳米粒,其可同时重编程TAM、抑制MDSC和阻断PD-1/PD-L1通路,以TAM、MDSC、CD8+ T细胞为直接调节靶点,利用瘤内免疫网络的串扰实现对NK细胞、树突状细胞和Treg的间接调节,从而全面激活固有和适应性抗肿瘤免疫应答。

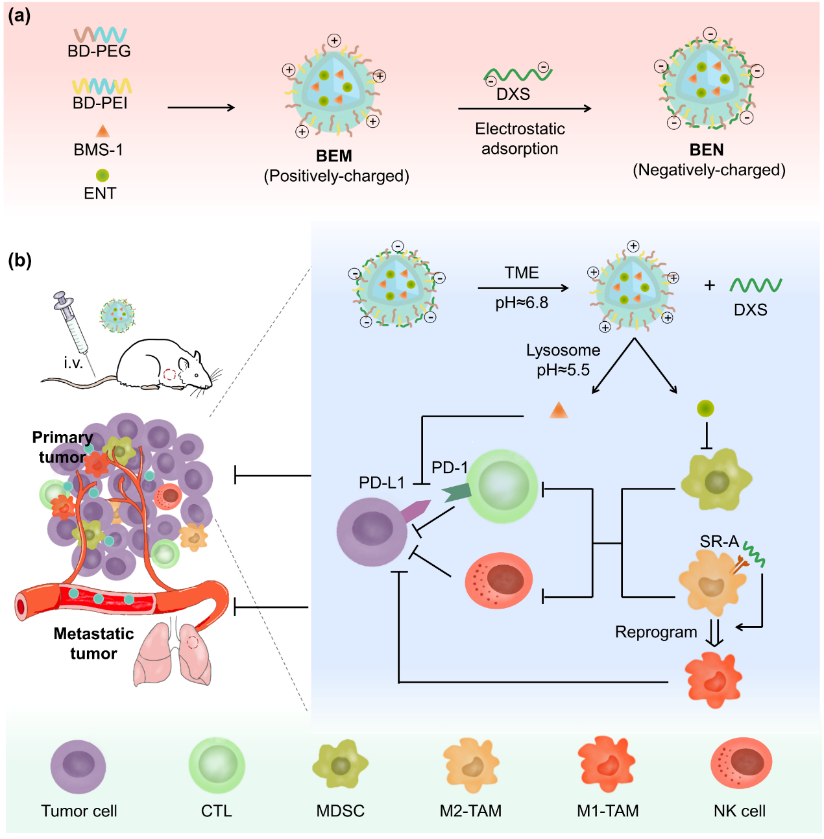
三元协同纳米粒BEN调节肿瘤免疫微环境治疗三阴性乳腺癌
研究团队首先合成了pH敏感的两亲性聚(β-氨基酯)衍生物,并用其构建了共递送MDSC抑制剂恩替诺特(ENT)和PD-1/PD-L1抑制剂BMS-1的胶束(BEM)。随后,将BEM与清道夫受体A(SR-A)的配体硫酸葡聚糖(DXS)通过静电吸附形成复合纳米粒BEN。BEN具有级联酸敏感性,即在pH 7.4时稳定、pH 6.8时DXS外壳脱落、pH 5.5时胶束解离。
研究发现,BEN可以实现有效的CAPIR(循环、蓄积、渗透、摄取、释放)过程。带负电的BEN在体内血液循环中保持稳定,有效延长药物半衰期,并通过被动靶向作用在肿瘤部位蓄积。在肿瘤弱酸性微环境中,DXS从BEN上解离,阻断TAM上的SR-A并诱导其向促炎的M1型分化。暴露出的BEM带正电,有利于瘤内渗透和细胞摄取,在溶酶体的酸性环境中,载体聚合物由两亲性变成亲水性,从而导致BEM解离,释放出BMS-1和ENT以阻断PD-1/PD-L1和抑制MDSC。
此外,在三种免疫调节药物的协同作用下,BEN重塑了肿瘤免疫微环境,提高瘤内巨噬细胞M1/M2比例、NK细胞数量和CD8+ T细胞数量,下调MDSC和Treg,有效激活固有和适应性抗肿瘤免疫反应,并诱导抗肿瘤免疫记忆,从而抑制肿瘤的生长、转移和复发。
上海药物所博士研究生颜雯璐为第一作者,李亚平研究员、尹琦研究员及临港实验室郎天群博士为论文共同通讯作者。该研究得到了科技部重点研发计划、国家自然科学基金、山东省自然科学基金和上海市“扬帆计划”等项目的资助。张江实验室国家蛋白质科学研究(上海)设施和上海药物所冷冻电镜研究中心也在实验中予以支持。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


