Science:全文解读!揭示Pax3 mRNA控制肌肉干细胞命运机制
来源:本站原创 2019-11-24 18:12
2019年11月24日讯/生物谷BIOON/---组织保持稳态和再生取决于组织特异性的干细胞群体,其中的一些干细胞群体长时间处于静止状态。在脊椎动物中,肌肉干细胞(MuSC)是骨骼肌再生所必需的。近期的研究已表明,久坐不动小鼠中的MuSC对成年肌纤维的维持起着重要的作用,它们对隔膜肌(diaphragm muscle)的贡献较大,而对下后肢肌(lower hindlimb muscle)的贡献较小
2019年11月24日讯/生物谷BIOON/---组织保持稳态和再生取决于组织特异性的干细胞群体,其中的一些干细胞群体长时间处于静止状态。在脊椎动物中,肌肉干细胞(MuSC)是骨骼肌再生所必需的。近期的研究已表明,久坐不动小鼠中的MuSC对成年肌纤维的维持起着重要的作用,它们对隔膜肌(diaphragm muscle)的贡献较大,而对下后肢肌(lower hindlimb muscle)的贡献较小。
在一项新的研究中,为了理解确定MuSC对成年肌纤维贡献程度的机制,美国斯坦福大学医学院的Thomas Rando及其研究团队测量了MuSC在不同的未遭受损伤的肌肉中激活并进入细胞周期的程度。当在体内用核苷酸类似物5-乙炔基-2'-脱氧尿苷(5-ethynyl-2'-deoxyuridine, EdU)对小鼠进行刺激以标记正在经历DNA复制的细胞后,他们观察到了广泛的EdU掺入。隔膜肌、股薄肌(gracilis)和三头肌(triceps muscle)表现出最高的MuSC数量,它们在稳态条件下自发地打破静止状态并进入细胞周期,而后肢肌(hindlimb muscle)表现出最低的MuSC数量。
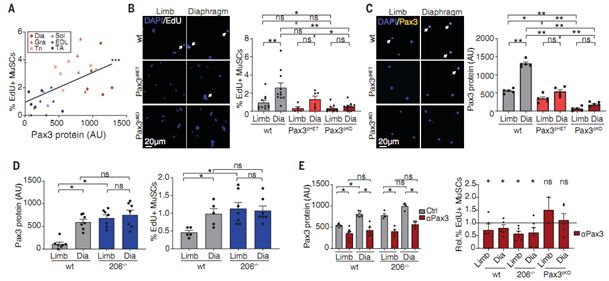
隔膜肌、股薄肌和三头肌中的MuSC表达高水平的转录因子Pax3,然而在大多数肢体肌肉(limb muscle)中的MuSC不表达Pax3。鉴于Pax3在胚胎发生期间促进细胞增殖和应对应激中已确立的作用,这些研究人员研究了Pax3是否在稳态期间调节MuSC激活过程。他们观察到在来自不同肌肉的MuSC中,Pax3与EdU掺入呈正相关。为了直接测试Pax3是否在MuSC的静止和激活之间保持平衡中发挥作用,他们使用Pax7-CreERT2对成年MuSC中的Pax3进行条件性剔除(所获得的小鼠称为Pax3cKO小鼠),发现隔膜肌MuSC和后肢肌MuSC中的Pax3 mRNA分别平均下降了96%和88%。在隔膜肌MuSC、股薄肌MuSC和三头肌MuSC中,不论在体外还是在体内,剔除Pax3导致静止标志物增加、MyoD减少和EdU掺入减少。
Rando实验室的先前研究已表明一种称为miR206的microRNA抑制从后肢肌分离的MuSC中的Pax3表达。他们分析了miR206敲除小鼠,发现后肢肌MuSC中的Pax3蛋白水平增加了,EdU掺入也相应地增加了。这些变化与隔膜肌MuSC中观察到的水平相当,而且可通过条件性剔除Pax3加以恢复。Pax3 mRNA水平没有变化,这表明miR206在翻译水平上调节Pax3蛋白。最后,Rando团队给野生型小鼠和miR206敲除小鼠注射反义体内吗啉代寡核苷酸(antisense vivo-morpholino oligonucleotide, AMO),这种AMO与Pax3的翻译起始位点互补,可阻止Pax3翻译。在野生型小鼠和miR206敲除小鼠的隔膜肌MuSC中,这导致Pax3蛋白水平降低并减少了EdU掺入,但在Pax3cKO小鼠的隔膜肌MuSC中则不会。相反,这种阻断miR206的AMO导致野生型小鼠的后肢肌MuSC中的Pax3蛋白水平和EdU掺入增加,但在miR206敲除小鼠和Pax3cKO小鼠的MuSC则不会。他们得出结论,Pax3增加了静止MuSC退出静止状态的倾向。
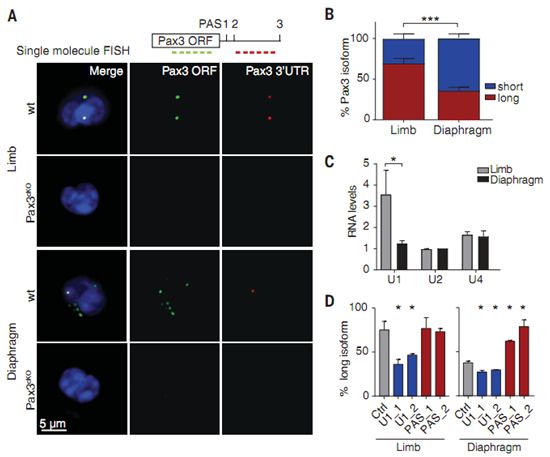
Rando实验室的先前研究已表明隔膜肌MuSC表达具有较短3'非翻译区(3'UTR)且缺乏miR206结合位点的Pax3转录异构体(transcript isoform)。通过使用单分子荧光原位杂交(smFISH),他们发现大多数隔膜肌MuSC主要表达较短的Pax3转录异构体,而大多数后肢肌MuSC主要表达较长的Pax3转录异构体。他们在miR206敲除小鼠的MuSC中观察到类似的Pax3转录异构体分布模式,这表明miR206并不影响Pax3转录异构体表达模式。这指示了一种MuSC调节Pax3蛋白水平的机制。在MuSC cDNA文库中,他们观察到相比于隔膜肌MuSC,后肢肌MuSC中的U1小核仁RNA(U1 snRNA)水平增加了,不过他们观察到在隔膜肌MuSC和后肢肌MuSC中,其他已知的选择性聚腺苷酸化因子水平相当。此外,通过对脊椎动物Pax3横向同源物进行多重序列比对,他们鉴定出位于最近端聚腺苷酸化位点(polyadenylation site, PAS)上游的两个保守性基序与U1 snRNA的共有序列相匹配。这表明U1 snRNA能够直接与Pax3 mRNA相互作用。U1 snRNA是小核仁核蛋白U1的RNA支架,其中作为一种大分子复合物,小核仁核蛋白U1识别5'剪接位点,作用于剪接体的外面,从而保护天然转录本不会过早终止转录和发生聚腺苷酸化。敲降(knockdown, 也可译为抑制)U1 snRNA导致较短的Pax3转录异构体,这与后肢肌MuSC表达更长的Pax3转录异构体和更高的U1 snRNA水平相一致。
为了评估U1 snRNA在MuSC发生的选择性性聚腺苷酸化中的作用,Rando团队构建出在绿色荧光蛋白编码基因下游表达Pax3 3'UTR的报告基因。敲降或过表达U1 snRNA分别导致远端的扩增子(amplicon)减少或增加。为了评估U1 snRNA在体内的MuSC中的作用,他们利用AMO对小鼠进行全身性处理来敲降U1 snRNA。他们观察到肢体MuSC中较长的Pax3转录异构体下降了,然而,隔膜肌MuSC中没有这种明显变化。
为了测试U1 snRNA是否通过Pax3 3'UTR中的保守性结合基序调节Pax3转录异构体表达,Rando团队设计了与这些基序互补的AMO(下称U1位点AMO),以便在Pax3 3'UTR上与U1 snRNA竞争。他们在用这些AMO处理的小鼠中观察到向较短的Pax3转录异构体切换。接下来,他们设计了与最近端聚腺苷酸化位点中的两个关键保守序列互补的AMO(下称PAS1 AMO),以与关键的聚腺苷酸化因子竞争并选择一个更远端的聚腺苷酸化位点。他们观察到在用这些AMO处理的小鼠中,隔膜肌MuSC中更长的Pax3转录异构体增加了。他们得出的结论是U1 snRNA在体内诱导了MuSC中更长的Pax3转录异构体表达,并且它通过Pax3转录本中的保守性基序起作用。
接下来,Rando团队探究了Pax3转录异构体表达的变化是否导致Pax3蛋白水平上的差异。鉴于只有较长的Pax3转录异构体包含miR206结合位点,因此只有这些较长的Pax3转录异构体对miR206水平变化敏感。他们用U1位点AMO或PAS1 AMO处理miR206敲除小鼠,然后用miR206模拟物转染纯化的MuSC。在体外培养24小时后,他们测量了Pax3蛋白水平。在来自经过对照AMO处理的miR206敲除小鼠的肢体MuSC中(主要表达较长的Pax3转录异构体),与对照(miR1模拟物)相比,miR206模拟物降低了Pax3蛋白水平。相比之下,来自用U1位点AMO处理的miR206敲除小鼠的肢体MuSC并未显示Pax3蛋白水平的任何下降,而来自用PAS1 AMO处理的miR206敲除小鼠的肢体MuSC确实显示出对miR206作出反应而引起的Pax3蛋白水平强烈下降。他们在隔膜肌MuSC中观察到了类似的表达模式,它们在基线时主要表达较短的Pax3转录异构体。敲降或过表达U1 snRNA分别导致来自野生型小鼠的MuSC中的Pax3蛋白水平升高或下降,但是在来自miR206敲除小鼠的MuSC中则不会。
鉴于较长的Pax3转录异构体对miR206调节更敏感,Rando团队接下来测试了这种调节是否在体内发生。敲降U1 snRNA可导致野生型小鼠中的Pax3蛋白水平呈剂量依赖性增加,但在miR206敲除小鼠中则不会。他们随后用U1位点AMO和PAS1 AMO处理野生型小鼠。阻断U1 snRNA结合位点导致来自野生型小鼠的 MuSC中的Pax3蛋白水平升高,但是在来自miR206敲除小鼠的MuSC中则不会;阻断PAS1会到Pax3蛋白水平下降。他们得出的结论是U1 snRNA诱导切换到更长的Pax3转录异构体,从而导致miR206抑制Pax3蛋白表达。
接下来,Rando团队考虑通过调节Pax3蛋白水平,U1 snRNA是否也影响MuSC激活。他们用U1位点AMO或PAS1 AMO处理了miR206敲除小鼠,纯化出MuSC,并在EdU存在下用miR206转染它们。对于用PAS1 AMO处理的小鼠,miR206转染导致肢体MuSC和隔膜肌MuSC中的EdU掺入减少。对于用U1位点AMO处理的小鼠,miR206转染并未导致EdU掺入的变化。U1 snRNA的过表达导致来自野生型小鼠的MuSC中的EdU掺入水平下降,但是来自miR206敲除小鼠或Pax3cKO小鼠的MuSC中则不会。
为了提供进一步证据来证实U1 snRNA在控制处于稳态条件下的MuSC激活中的作用,Rando团队用U1位点AMO或PAS1 AMO处理了野生型小鼠。阻断U1结合位点导致来自野生型小鼠的肢体MuSC和隔膜肌MuSC中的EdU掺入增加,而阻断近端聚腺苷酸化位点导致EdU掺入减少。但是,这些AMO对miR206敲除小鼠或Pax3cKO小鼠没有影响。这些数据表明,在稳态条件下,U1 snRNA通过Pax3的选择性多聚腺苷酸化作用控制MuSC激活。
为了在体内探究Pax3在MuSC中的功能相关性,Rando团队条件性地剔除了3个月大小鼠的MuSC中的Pax3,在2周或9个月后,并未观察到MuSC的数量出现差异。通过使用增强型黄色荧光蛋白(eYFP)作为MuSC的一种谱系示踪剂,他们在9个月后在肌纤维中观察到明显的eYFP表达。在野生型小鼠的隔膜肌中大约50%的肌纤维呈阳性(即表达eYFP),在野生型小鼠的胫前肌(tibialis anterior)中,10%的肌纤维呈阳性,这与以前的报道相一致。在这些经过条件性剔除Pax3的小鼠中,较少的隔膜肌纤维显示出与MuSC融合的证据。在这些小鼠中,他们观察到隔膜肌和三头肌而不是胫前肌中的肌纤维大小显著下降。与此相一致的是,Pax3cKO小鼠显示出握力下降并且在跑步机测定中显示出较差的表现。他们得出的结论是,在MuSC表达高水平Pax3的肌肉中,Pax3表达对于这种组织的结构和功能保持稳态至关重要。
先前的研究已表明,MuSC与成熟肌纤维的融合频率在不同的肌肉中是不同的。在这项新的研究中,Rando团队为这种异质性提供了分子水平上的证据,表明Pax3表达调节了MuSC促进肌肉保持稳态的倾向。此外,他们描述了Pax3在来自不同肌肉的MuSC中差异性表达的分子机制。他们发现U1 snRNA与Pax3 mRNA相互作用以确定Pax3转录异构体的表达模式,因而也就确定对miR206抑制的敏感性。总之,U1 snRNA、miR206和Pax3 mRNA共同对Pax3蛋白表达进行调节,从而控制MuSC在稳态条件下的自发性激活和细胞周期进入。(生物谷 Bioon.com)
参考资料:
1.Antoine de Morree et al. Alternative polyadenylation of Pax3 controls muscle stem cell fate and muscle function. Science, 2019, doi:10.1126/science.aax1694.
2.Haibin Xi et al. Beyond the genome: RNA control of stem cells. Science, 2019, doi:10.1126/science.aaz4859.
在一项新的研究中,为了理解确定MuSC对成年肌纤维贡献程度的机制,美国斯坦福大学医学院的Thomas Rando及其研究团队测量了MuSC在不同的未遭受损伤的肌肉中激活并进入细胞周期的程度。当在体内用核苷酸类似物5-乙炔基-2'-脱氧尿苷(5-ethynyl-2'-deoxyuridine, EdU)对小鼠进行刺激以标记正在经历DNA复制的细胞后,他们观察到了广泛的EdU掺入。隔膜肌、股薄肌(gracilis)和三头肌(triceps muscle)表现出最高的MuSC数量,它们在稳态条件下自发地打破静止状态并进入细胞周期,而后肢肌(hindlimb muscle)表现出最低的MuSC数量。

Pax3控制处于稳态条件下的肌肉干细胞激活,图片来自Science, 2019, doi:10.1126/science.aax1694。
隔膜肌、股薄肌和三头肌中的MuSC表达高水平的转录因子Pax3,然而在大多数肢体肌肉(limb muscle)中的MuSC不表达Pax3。鉴于Pax3在胚胎发生期间促进细胞增殖和应对应激中已确立的作用,这些研究人员研究了Pax3是否在稳态期间调节MuSC激活过程。他们观察到在来自不同肌肉的MuSC中,Pax3与EdU掺入呈正相关。为了直接测试Pax3是否在MuSC的静止和激活之间保持平衡中发挥作用,他们使用Pax7-CreERT2对成年MuSC中的Pax3进行条件性剔除(所获得的小鼠称为Pax3cKO小鼠),发现隔膜肌MuSC和后肢肌MuSC中的Pax3 mRNA分别平均下降了96%和88%。在隔膜肌MuSC、股薄肌MuSC和三头肌MuSC中,不论在体外还是在体内,剔除Pax3导致静止标志物增加、MyoD减少和EdU掺入减少。
Rando实验室的先前研究已表明一种称为miR206的microRNA抑制从后肢肌分离的MuSC中的Pax3表达。他们分析了miR206敲除小鼠,发现后肢肌MuSC中的Pax3蛋白水平增加了,EdU掺入也相应地增加了。这些变化与隔膜肌MuSC中观察到的水平相当,而且可通过条件性剔除Pax3加以恢复。Pax3 mRNA水平没有变化,这表明miR206在翻译水平上调节Pax3蛋白。最后,Rando团队给野生型小鼠和miR206敲除小鼠注射反义体内吗啉代寡核苷酸(antisense vivo-morpholino oligonucleotide, AMO),这种AMO与Pax3的翻译起始位点互补,可阻止Pax3翻译。在野生型小鼠和miR206敲除小鼠的隔膜肌MuSC中,这导致Pax3蛋白水平降低并减少了EdU掺入,但在Pax3cKO小鼠的隔膜肌MuSC中则不会。相反,这种阻断miR206的AMO导致野生型小鼠的后肢肌MuSC中的Pax3蛋白水平和EdU掺入增加,但在miR206敲除小鼠和Pax3cKO小鼠的MuSC则不会。他们得出结论,Pax3增加了静止MuSC退出静止状态的倾向。
Rando实验室的先前研究已表明隔膜肌MuSC表达具有较短3'非翻译区(3'UTR)且缺乏miR206结合位点的Pax3转录异构体(transcript isoform)。通过使用单分子荧光原位杂交(smFISH),他们发现大多数隔膜肌MuSC主要表达较短的Pax3转录异构体,而大多数后肢肌MuSC主要表达较长的Pax3转录异构体。他们在miR206敲除小鼠的MuSC中观察到类似的Pax3转录异构体分布模式,这表明miR206并不影响Pax3转录异构体表达模式。这指示了一种MuSC调节Pax3蛋白水平的机制。在MuSC cDNA文库中,他们观察到相比于隔膜肌MuSC,后肢肌MuSC中的U1小核仁RNA(U1 snRNA)水平增加了,不过他们观察到在隔膜肌MuSC和后肢肌MuSC中,其他已知的选择性聚腺苷酸化因子水平相当。此外,通过对脊椎动物Pax3横向同源物进行多重序列比对,他们鉴定出位于最近端聚腺苷酸化位点(polyadenylation site, PAS)上游的两个保守性基序与U1 snRNA的共有序列相匹配。这表明U1 snRNA能够直接与Pax3 mRNA相互作用。U1 snRNA是小核仁核蛋白U1的RNA支架,其中作为一种大分子复合物,小核仁核蛋白U1识别5'剪接位点,作用于剪接体的外面,从而保护天然转录本不会过早终止转录和发生聚腺苷酸化。敲降(knockdown, 也可译为抑制)U1 snRNA导致较短的Pax3转录异构体,这与后肢肌MuSC表达更长的Pax3转录异构体和更高的U1 snRNA水平相一致。
为了评估U1 snRNA在MuSC发生的选择性性聚腺苷酸化中的作用,Rando团队构建出在绿色荧光蛋白编码基因下游表达Pax3 3'UTR的报告基因。敲降或过表达U1 snRNA分别导致远端的扩增子(amplicon)减少或增加。为了评估U1 snRNA在体内的MuSC中的作用,他们利用AMO对小鼠进行全身性处理来敲降U1 snRNA。他们观察到肢体MuSC中较长的Pax3转录异构体下降了,然而,隔膜肌MuSC中没有这种明显变化。
为了测试U1 snRNA是否通过Pax3 3'UTR中的保守性结合基序调节Pax3转录异构体表达,Rando团队设计了与这些基序互补的AMO(下称U1位点AMO),以便在Pax3 3'UTR上与U1 snRNA竞争。他们在用这些AMO处理的小鼠中观察到向较短的Pax3转录异构体切换。接下来,他们设计了与最近端聚腺苷酸化位点中的两个关键保守序列互补的AMO(下称PAS1 AMO),以与关键的聚腺苷酸化因子竞争并选择一个更远端的聚腺苷酸化位点。他们观察到在用这些AMO处理的小鼠中,隔膜肌MuSC中更长的Pax3转录异构体增加了。他们得出的结论是U1 snRNA在体内诱导了MuSC中更长的Pax3转录异构体表达,并且它通过Pax3转录本中的保守性基序起作用。

U1 snRNA控制Pax3的长度及其对miR206的敏感性,图片来自Science, 2019, doi:10.1126/science.aax1694。
接下来,Rando团队探究了Pax3转录异构体表达的变化是否导致Pax3蛋白水平上的差异。鉴于只有较长的Pax3转录异构体包含miR206结合位点,因此只有这些较长的Pax3转录异构体对miR206水平变化敏感。他们用U1位点AMO或PAS1 AMO处理miR206敲除小鼠,然后用miR206模拟物转染纯化的MuSC。在体外培养24小时后,他们测量了Pax3蛋白水平。在来自经过对照AMO处理的miR206敲除小鼠的肢体MuSC中(主要表达较长的Pax3转录异构体),与对照(miR1模拟物)相比,miR206模拟物降低了Pax3蛋白水平。相比之下,来自用U1位点AMO处理的miR206敲除小鼠的肢体MuSC并未显示Pax3蛋白水平的任何下降,而来自用PAS1 AMO处理的miR206敲除小鼠的肢体MuSC确实显示出对miR206作出反应而引起的Pax3蛋白水平强烈下降。他们在隔膜肌MuSC中观察到了类似的表达模式,它们在基线时主要表达较短的Pax3转录异构体。敲降或过表达U1 snRNA分别导致来自野生型小鼠的MuSC中的Pax3蛋白水平升高或下降,但是在来自miR206敲除小鼠的MuSC中则不会。
鉴于较长的Pax3转录异构体对miR206调节更敏感,Rando团队接下来测试了这种调节是否在体内发生。敲降U1 snRNA可导致野生型小鼠中的Pax3蛋白水平呈剂量依赖性增加,但在miR206敲除小鼠中则不会。他们随后用U1位点AMO和PAS1 AMO处理野生型小鼠。阻断U1 snRNA结合位点导致来自野生型小鼠的 MuSC中的Pax3蛋白水平升高,但是在来自miR206敲除小鼠的MuSC中则不会;阻断PAS1会到Pax3蛋白水平下降。他们得出的结论是U1 snRNA诱导切换到更长的Pax3转录异构体,从而导致miR206抑制Pax3蛋白表达。
接下来,Rando团队考虑通过调节Pax3蛋白水平,U1 snRNA是否也影响MuSC激活。他们用U1位点AMO或PAS1 AMO处理了miR206敲除小鼠,纯化出MuSC,并在EdU存在下用miR206转染它们。对于用PAS1 AMO处理的小鼠,miR206转染导致肢体MuSC和隔膜肌MuSC中的EdU掺入减少。对于用U1位点AMO处理的小鼠,miR206转染并未导致EdU掺入的变化。U1 snRNA的过表达导致来自野生型小鼠的MuSC中的EdU掺入水平下降,但是来自miR206敲除小鼠或Pax3cKO小鼠的MuSC中则不会。
为了提供进一步证据来证实U1 snRNA在控制处于稳态条件下的MuSC激活中的作用,Rando团队用U1位点AMO或PAS1 AMO处理了野生型小鼠。阻断U1结合位点导致来自野生型小鼠的肢体MuSC和隔膜肌MuSC中的EdU掺入增加,而阻断近端聚腺苷酸化位点导致EdU掺入减少。但是,这些AMO对miR206敲除小鼠或Pax3cKO小鼠没有影响。这些数据表明,在稳态条件下,U1 snRNA通过Pax3的选择性多聚腺苷酸化作用控制MuSC激活。
为了在体内探究Pax3在MuSC中的功能相关性,Rando团队条件性地剔除了3个月大小鼠的MuSC中的Pax3,在2周或9个月后,并未观察到MuSC的数量出现差异。通过使用增强型黄色荧光蛋白(eYFP)作为MuSC的一种谱系示踪剂,他们在9个月后在肌纤维中观察到明显的eYFP表达。在野生型小鼠的隔膜肌中大约50%的肌纤维呈阳性(即表达eYFP),在野生型小鼠的胫前肌(tibialis anterior)中,10%的肌纤维呈阳性,这与以前的报道相一致。在这些经过条件性剔除Pax3的小鼠中,较少的隔膜肌纤维显示出与MuSC融合的证据。在这些小鼠中,他们观察到隔膜肌和三头肌而不是胫前肌中的肌纤维大小显著下降。与此相一致的是,Pax3cKO小鼠显示出握力下降并且在跑步机测定中显示出较差的表现。他们得出的结论是,在MuSC表达高水平Pax3的肌肉中,Pax3表达对于这种组织的结构和功能保持稳态至关重要。
先前的研究已表明,MuSC与成熟肌纤维的融合频率在不同的肌肉中是不同的。在这项新的研究中,Rando团队为这种异质性提供了分子水平上的证据,表明Pax3表达调节了MuSC促进肌肉保持稳态的倾向。此外,他们描述了Pax3在来自不同肌肉的MuSC中差异性表达的分子机制。他们发现U1 snRNA与Pax3 mRNA相互作用以确定Pax3转录异构体的表达模式,因而也就确定对miR206抑制的敏感性。总之,U1 snRNA、miR206和Pax3 mRNA共同对Pax3蛋白表达进行调节,从而控制MuSC在稳态条件下的自发性激活和细胞周期进入。(生物谷 Bioon.com)
参考资料:
1.Antoine de Morree et al. Alternative polyadenylation of Pax3 controls muscle stem cell fate and muscle function. Science, 2019, doi:10.1126/science.aax1694.
2.Haibin Xi et al. Beyond the genome: RNA control of stem cells. Science, 2019, doi:10.1126/science.aaz4859.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


