研究揭示细胞促凋亡蛋白BAK的全新激活位点
来源:合肥研究院 2020-07-14 19:03
近期,中国科学院合肥物质科学研究院研究员戴海明团队在细胞凋亡研究领域取得进展,揭示了细胞促凋亡蛋白BAK全新的激活位点,BMF和HRK能够直接结合在BAK蛋白α4、α6和α7螺旋形成的沟槽上,这是一个之前没发现的新激活位点。该项研究不仅进一步完善了细胞凋亡的激活机制,而且为进一步以BAK为靶点研发诱导细胞凋亡的靶向药物提供了新的可能。由BCL2家
近期,中国科学院合肥物质科学研究院研究员戴海明团队在细胞凋亡研究领域取得进展,揭示了细胞促凋亡蛋白BAK全新的激活位点,BMF和HRK能够直接结合在BAK蛋白α4、α6和α7螺旋形成的沟槽上,这是一个之前没发现的新激活位点。该项研究不仅进一步完善了细胞凋亡的激活机制,而且为进一步以BAK为靶点研发诱导细胞凋亡的靶向药物提供了新的可能。
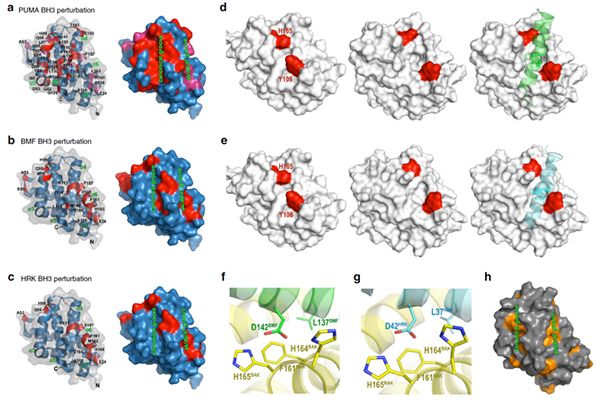
由BCL2家族蛋白介导的线粒体途径凋亡是细胞凋亡的主要调控方式。其中,BAK和BAX是线粒体膜通透的主要执行者。在受到BH3-only蛋白激活后,BAK和BAX能够形成多聚,并引起线粒体外膜的穿孔,从而诱导细胞色素c等物质的释放,激活caspase级联反应,导致细胞凋亡的发生。胁迫条件能够诱导BH3-only蛋白的显着上调,从而直接或间接激活BAK或BAX。目前已发现的BH3-only蛋白主要包括BIM、PUMA、tBID、NOXA、BAD、BMF、HRK以及BIK。之前的研究表明,BIM、PUMA和tBID能够直接通过经典的BH3结合口袋与BAK结合,从而激活BAK。然而,其他BH3-only蛋白如BMF、HRK和BIK等,能否直接激活BAK还不清楚。
该研究团队不仅在分子及细胞水平证实BMF和HRK能够直接激活BAK,而且发现, 相对于BIM、PUMA和tBID与BAK的经典结合模式,BMF和HRK能够直接结合BAK的另一个结合位点,从而直接激活BAK。通过蛋白质核磁共振和分子动力学模拟等研究发现,BMF和HRK能够直接结合在BAK蛋白α4、α6和α7螺旋形成的沟槽上,而这是一个之前没发现的新激活位点。进一步通过点突变、脂质体模拟以及细胞内研究发现,新结合位点中的一些关键氨基酸的突变能够显着降低BMF/HRK与BAK的结合能力,降低BAK穿膜和诱导细胞凋亡的能力,从而进一步证明新的BAK的BH3蛋白结合位点对于BMF和HRK介导的细胞凋亡具有重要作用。 (生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


