Cell:给CAR-T细胞穿上“隐身衣”,魏文胜团队开发新型通用型CAR-T疗法,已开展人体临床试验
来源:生物世界 2025-08-23 14:51
该研究通过 CRISPR 全基因组筛选,成功锁定了一个关键的糖基化调控基因 SPPL3,敲除该基因的 T 细胞表面会形成致密的糖基化修饰层。
自体 CAR-T 细胞疗法已彻底改变了侵袭性 B 细胞恶性肿瘤的治疗格局。然而,这种开创性的疗法受到了生产制造流程复杂、存储运输要求高、等待时间漫长以及成本高昂等因素的严重限制。
为了克服这些局限性,“现货型”的同种异体 CAR-T 细胞疗法已作为一项有前景的替代疗法崭露头角,即使用来自健康供体的 T 细胞(而非患者自体 T 细胞)改造后输入患者,实现现货化和规模化生产。然而,这种策略也面临着一些挑战,主要是移植物抗宿主病(GvHD),即供体 T 细胞攻击患者的细胞和组织;宿主抗移植物反应(HvG),即患者的 T 细胞和 NK 细胞会识别并清除外来的供体 T 细胞,以及活化诱导的细胞死亡(AICD),导致治疗效果难以持久。
因此,尽管自体 CAR-T 细胞疗法取得了许多成功,但同种异体 CAR-T 细胞疗法要想发挥持久治疗效果且避免排斥反应,仍然面临着巨大挑战。
与此同时,同种异体 CAR-T 细胞的持久性有限,是由宿主的 T 细胞和自然杀伤(NK)细胞的宿主抗移植物反应(HvG)以及激活诱导的细胞死亡(AICD)所驱动的。
2025 年 8 月,北京大学/昌平实验室魏文胜教授、昌平实验室/南开大学/解放军总医学韩为东教授、博雅辑因袁鹏飞博士作为共同通讯作者(武泽光、施锦红、拉毛切忠、邱圆圆、杨金鑫、刘洋、梁霏霏为共同第一作者)在国际顶尖学术期刊 Cell 上发表了题为:Glycan shielding enables TCR-sufficient allogeneic CAR-T therapy 的研究论文。
该研究通过 CRISPR 全基因组筛选,成功锁定了一个关键的糖基化调控基因 SPPL3,敲除该基因的 T 细胞表面会形成致密的糖基化修饰层,基于这一发现,研究团队构建了 SPPL3 基因敲除的同种异体 CAR-T 细胞疗法,相当于给 CAR-T 细胞穿上了“隐身衣”,既能躲避免疫系统的杀伤,又能减轻 GvHD,同时保留抗癌战斗力,提高治疗的持久性。
研究团队还在 IIT 临床试验中证实了该方法的安全性和潜在治疗效果,有望让“通用型”CAR-T 细胞疗法真正迈向“现货时代”。

同种异体 CAR-T 的“三座大山”
使用来自健康供体的 T 细胞(而非患者自体 T 细胞)改造后输入患者,能够实现 CAR-T 细胞的现货化和规模化生产,是自体 CAR-T 细胞的一种极具前景的替代方法。
然而,这些同种异体 CAR-T 细胞要想持久发挥治疗效果,面临着着“三座大山”——
1、移植物抗宿主病(GvHD):异体 CAR-T 细胞在输注到患者体内后,将患者的细胞和组织当作“敌人”进行攻击;
2、宿主抗移植物反应(HvG):患者自身的 T 细胞和 NK 细胞把输注到体内的异体 CAR-T 细胞当作“外来者”直接清除;
3. 活化诱导的细胞死亡(AICD):反复免疫刺激后的 CAR-T 细胞通过 Fas/FasL 出发触发程序性死亡。
给 CAR-T 细胞穿上“隐形衣”
研究团队使用 CRISPR 全基因组筛选,锁定一个关键基因——SPPL3。SPPL3 是糖链“剪刀手”,剪掉糖基化修饰。而敲除原代 T 细胞的 SPPL3 后,糖链变多变长,使其能够通过糖链介导实现免疫逃逸,像给 T 细胞穿上了“隐身衣”,把 TCR、HLA 等“身份标签”遮盖住,宿主就认不出来了。
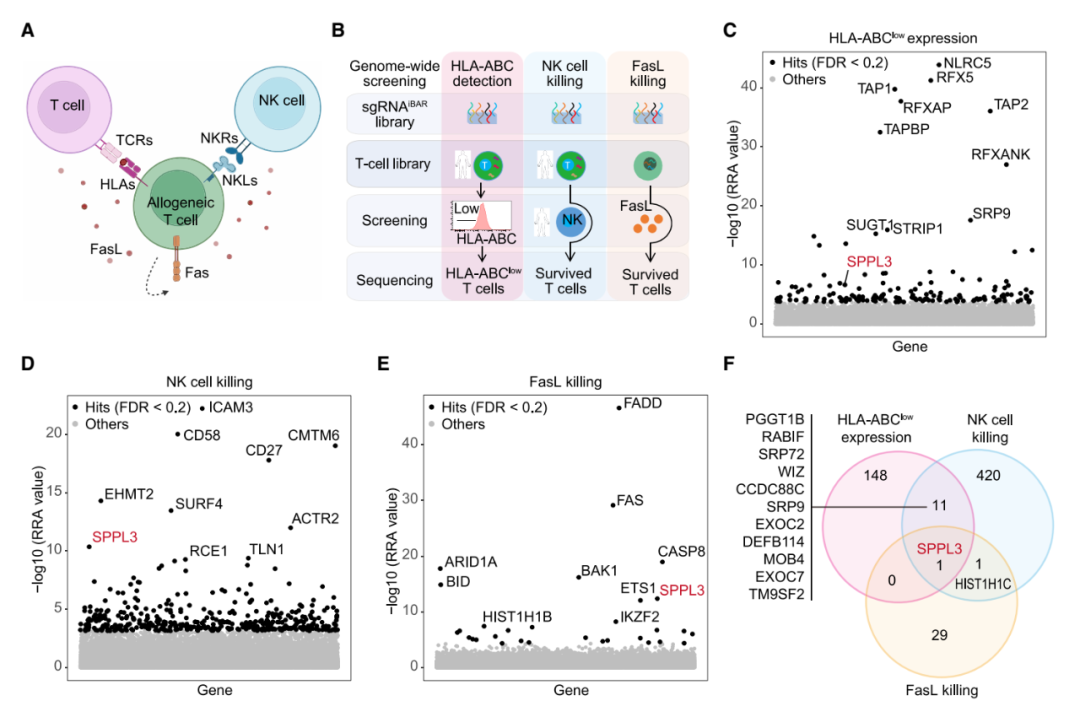
实验结果显示,SPPL3 敲除的 CAR-T 细胞在体外抵抗了 Fas/FasL 触发的活化诱导的细胞死亡(AICD)、抵御了 NK 细胞的杀伤,削弱了宿主 T 细胞通过 TCR 介导的识别与清除。在小鼠体内,SPPL3 敲除的 CAR-T 细胞完全清除了肿瘤,显著延长了生存期。此外,SPPL3 敲除并不影响抗 CD19 CAR 分子的功能,确保了抗癌功能不打折。
两项人体试验
基于上述临床前实验结果,研究团队开启了一项 IIT 临床试验中,使用 SPPL3 和 TCR 双敲除的抗 CD19 同种异体 CAR-T 细胞治疗了 9 名复发/难治性 B 细胞非霍奇金淋巴瘤(B-NHL)患者。
该试验达到了安全性终点,无剂量限制性毒性,未观察到 ≥2 级 GvHD,有 3 名患者出现了 ≥3 级细胞因子风暴,但均通过托珠单抗/激素控制,未出现预期外的长期毒性。但这些 CAR-T 细胞在患者体内存活时间有限。研究团队推断,TCR 可能对维持 T 细胞的长期存活至关重要。
因此,研究团队开启了第二项 IIT 临床试验,评估了 SPPL3 敲除但 TCR 完整保留的抗 CD19 同种异体 CAR-T 细胞对 3 名淋巴瘤或白血病患者的安全性以及治疗效果。结果显示,并未观察到 GvHD 的临床迹象,CAR-T 细胞在患者体内持续存在了 6 个月以上,其中一名患者 1 个月即获达完全缓解(CR),且在 6 个月时仍持久缓解。
该研究的核心发现:
SPPL3 缺失会提高原代 T 细胞的糖基化的水平和形式;
SPPL3 缺失会降低 TCR 表达,从而导致同种异体免疫下降;
SPPL3 缺失不会削弱抗 CD19 同种异体 CAR-T 细胞对肿瘤的控制作用;
SPPL3 缺失、TCR 完整的抗 CD19 同种异体 CAR-T 疗法在三名癌症患者中是安全的。
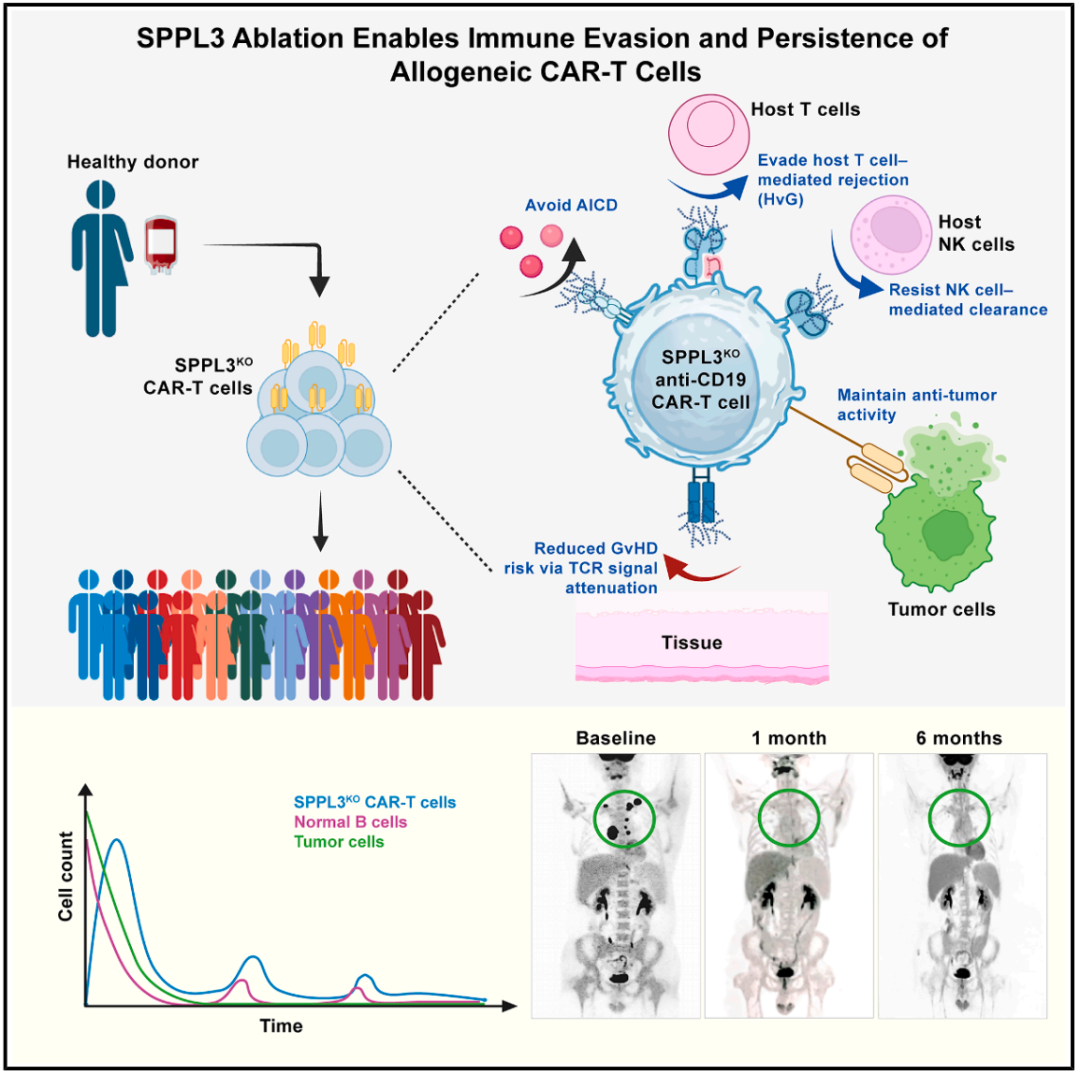
总的来说,该研究通过 CRISPR 全基因组筛选,提出了一种突破通用型 CAR-T 细胞疗法免疫屏障的全新策略。敲除了 SPPL3 基因的 CAR-T 细胞,不仅保留了 CAR 介导的抗肿瘤能力,还显著增强了免疫耐受性以及在体内的持久性,从而提供了一种能够保留 TCR 的通用型 CAR-T 细胞疗法的可行方案。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


