前噬菌体介导耐药基因水平传播新机制
来源:生物探索 2023-07-11 15:05
南京农业大学动物医学院兽药残留与耐药性风险评估中心王丽平教授团队联合动物科技学院刘金鑫教授在 ISME Journal (IF=11)在线发表了题为“Conjugative transfer of s
前噬菌体(Prophages)在包括毒力因子在内的多种功能性状的转导中发挥重要作用,但在携带和传播抗微生物抗性基因(ARGs)方面仍存在争议。
南京农业大学动物医学院兽药残留与耐药性风险评估中心王丽平教授团队联合动物科技学院刘金鑫教授在 ISME Journal 在线发表了题为“Conjugative transfer of streptococcal prophages harboring antibiotic resistance and virulence genes”的研究论文,该研究揭示了前噬菌体在链球菌耐药性水平传播中的重要作用及其相关机制,为噬菌体治疗的风险评估和耐药菌感染的防控奠定了基础。

抗生素耐药性(AMR)已经对全球公共卫生和经济造成严重威胁。多重耐药肺炎链球菌、红霉素耐药化脓性链球菌和克林霉素耐药无乳链球菌等均被列入WHO和美国CDC抗生素耐药性威胁列表。猪链球菌作为链球菌属的重要成员,是一个新发再发人兽共患病原,近年来耐药性问题也日趋严重,对人畜健康造成极大威胁,被认为是上述链球菌耐药基因传播的储库。整合性接合元件(ICEs)和整合性可移动元件(IMEs)等可移动遗传元件(MGEs)是介导链球菌属细菌耐药基因(ARGs)水平转移的重要元件,除此之外,链球菌属细菌染色体中也存在大量前噬菌体,表明其在细菌进化过程中起重要作用,但因缺乏有关噬菌体直接编码耐药基因的系统研究,噬菌体介导耐药基因水平转移的效率和机制尚未完全阐明,故其在耐药性水平传播中的作用一直被低估。
该研究采用噬菌体-耐药基因双向鉴定策略系统分析了数据库中10,983个和临床分离的736个链球菌基因组中的前噬菌体和耐药基因,鉴定了一类可直接编码ARGs的前噬菌体家族(SMphages)。SMphages分布于包括猪链球菌和无乳链球菌在内的21种链球菌种属中,携带包括万古霉素耐药基因簇vanG和噁唑烷酮类耐药基因optrA在内的10大类25种耐药基因,Tanglegram分析提示SMphages存在广泛的种内和中间水平转移现象。但是链球菌中噬菌体的转导和溶源化效率低且宿主谱窄,传统的转导水平转移途径不足以解释SMphages在链球菌中的广泛分布。因此推测尚存在未被鉴定的转移机制介导前噬菌体在链球菌属间的水平转移。
为验证该假设,研究人员设计了一组试验来鉴定SMphages的水平转移途径以及其它可移动元件在其转移过程中的作用。试验选取了4株携带SMphages的链球菌,包括2株ICE-negative猪链球菌,1株ICE-positive猪链球菌和1株ICE-positive停乳链球菌,研究发现SMphages通过转导和转化途径进行转移的作用非常有限,而是可通过高频率的接合途径进行水平转移。研究进一步通过构建ICE敲除和回补株,证实ICE无论存在于供体菌还是受体菌,均可动员SMpahges的通过接合方式进行高频率水平转移,转移至受体菌后,又可通过位点特异性重组和同源重组的方式整合到宿主菌染色体上。前噬菌体借助ICE进行接合转移新途径的发现,为研究不同可移动遗传元件相互作用机制奠定理论基础,同时,也提出警示前噬菌体作为ARGs的储库和转移载体,其引起的ARGs扩散风险也是不容忽视的。
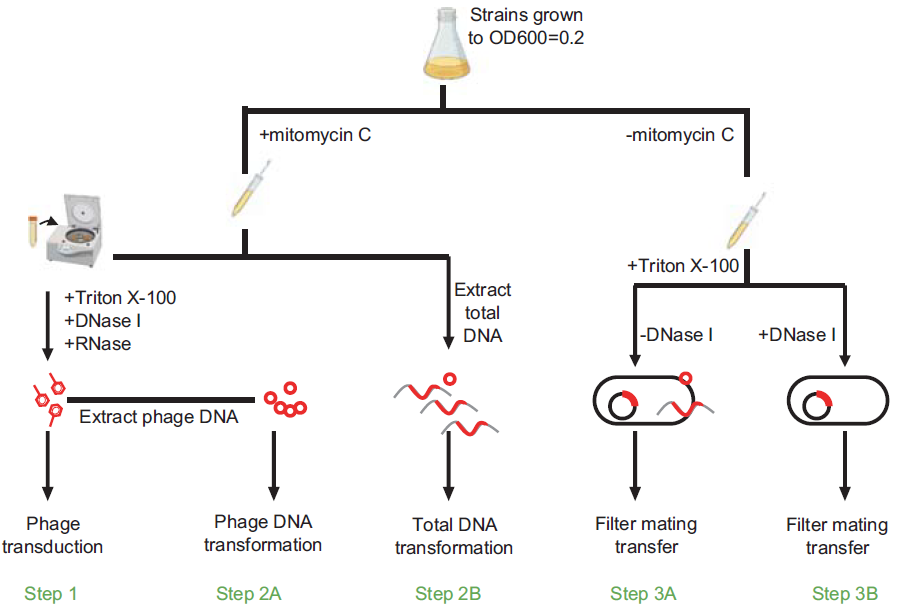
SMphages的HGT机制(图源:ISME Journal )
团队成员黄金虎副教授、博士生代兴杨和美国爱荷华州立大学Zuowei Wu博士为论文第一作者;王丽平教授和刘金鑫教授为通讯作者。美国华盛顿州立大学Douglas R. Call教授、爱荷华州立大学Xiao Hu博士、中国农业大学汪洋教授、动物科技学院毛胜勇教授、动物医学院刘广锦副教授、王晓明副研究员,以及研究生孙俊杰、唐一骏、张婉秋、韩沛钊、赵佳琪参与了研究。该研究获得了国家重点研发计划((2022YFD1800400)、国家自然科学基金((32172917、32072915和31872517)等项目资助。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


