CRM:复旦大学附属肿瘤医院团队,发现LTA4H改善肿瘤微环境,并抑制肝癌进展的机制!
来源:奇点糕 2025-04-01 09:41
来自复旦大学附属肿瘤医院的王红阳、陈磊研究团队,发现了LTA4H低表达促进HCC的发生和发展。
在肝细胞癌(HCC)的治疗中,了解肿瘤微环境(TME)的免疫逃避机制是改善治疗结果的关键。通过预测生物标志物识别治疗反应的预测特征,有助于应对HCC患者的异质性反应,为患者分层提供依据。
白三烯A4水解酶(LTA4H)是一种多功能锌金属酶,催化生成的产物白三烯B4(LTB4)是一种强效炎症介质。LTA4H在多种恶性肿瘤中高表达,通过增强肿瘤细胞增殖来促进肿瘤进展。
来自复旦大学附属肿瘤医院的王红阳、陈磊研究团队,发现了LTA4H低表达促进HCC的发生和发展。
从机制上来说,LTA4H通过抑制HNRNPA1介导的Ltbp1 mRNA成熟和加工来负向调节LTBP1表达。当LTA4H缺失时,LTBP1表达上调,进一步促进TGF-β的分泌与活化,诱导CD206+巨噬细胞极化,营造免疫抑制的肿瘤微环境。
抗TGF-β抗体和抗PD-1抗体联合治疗可显著改善LTA4H缺失HCC的免疫治疗耐药性。
研究发表在Cell Reports Medicine杂志上。

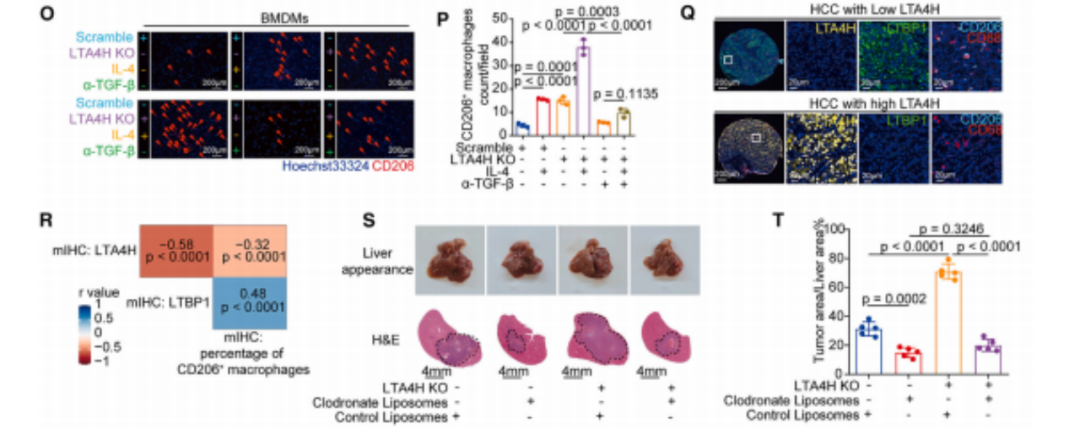
研究人员首先分析了LTA4H在人HCC组织和配对临近组织中的表达。分析结果表明,LTA4H水平在HCC中显著下调,低LTA4H水平与患者总生存期和无复发生存期显著缩短,以及不良预后有关。特异性敲除HCC小鼠LTA4H基因,可以观察到小鼠肝损伤恶化,肿瘤数量增加。
在LTA4H缺陷HCC模型中,CD206+巨噬细胞和中性粒细胞浸润增加,TME向M2巨噬细胞高浸润方向转变。
分析肝细胞LTA4H缺失或LTA4H正常表达时的差异表达基因,可以发现9种基因在LTA4H缺陷肝细胞中显著上调,与M2巨噬细胞极化有关。进一步分析发现,LTBP1水平在LTA4H缺陷细胞中上调,在LTA4H过表达细胞中下调。
肝细胞特异性LTA4H缺失通过上调LTBP1表达和TGF-β分泌促进M2巨噬细胞极化
LTBP1参与TGF-β的分泌和活化,而TGF-β可以促进M2巨噬细胞极化,在HCC进展中起着关键作用。细胞实验显示,阻断TGF-β可以消除LTA4H缺失诱导的M2巨噬细胞极化。
在探究LTA4H调节LTBP1水平机制时,研究人员发现,不论LTA4H缺失或LTA4H过表达,肝细胞中Ltbp1 mRNA水平没有差异,这就说明LTA4H并不是通过调节转录,而可能是通过调节mRNA加工来调节LTBP1表达的。
经过鉴定,微管蛋白Alpha 4a(TUBA4A)和异质核糖核蛋白A1(HNRNPA1)被认为是LTA4H的潜在相互作用蛋白,进一步实验显示,敲低HNRNPA1表达会降低肝细胞中的LTBP1蛋白和Ltbp1 mRNA水平。LTA4H通过抑制HNRNPA1介导的Ltbp1 mRNA成熟和加工来负向调节LTBP1表达。
综上所述,LTA4H下调通过靶向HNRNPA1/LTBP1/TGF-β轴,重塑肿瘤免疫微环境,促进肿瘤进展。
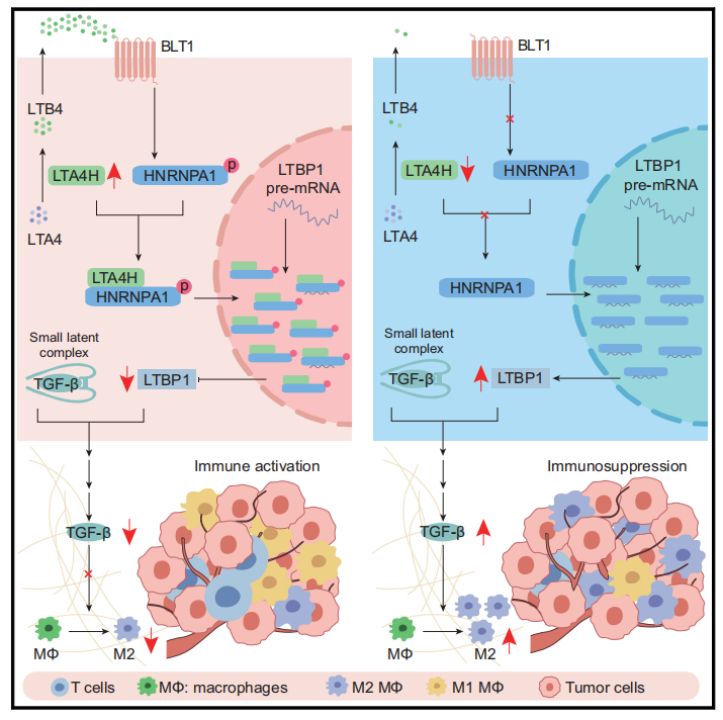
研究主要机制
鉴于阻断TGF-β可以破坏LTA4H下调诱导的免疫抑制微环境,研究人员尝试能否通过TGF-β阻断来增强抗PD-1疗法的疗效。在小鼠HCC模型中,LTA4H缺失小鼠对抗PD-1抗体单药治疗产生耐药性;抗PD-1抗体联合抗TGF-β抗体治疗,可以显著降低M2巨噬细胞水平,增强CD8+T细胞的浸润和活性,恢复对抗PD-1抗体治疗的敏感性。
临床分析进一步表明,LTA4H水平较高的HCC患者对ICI治疗的反应更好。这提示LTA4H可以作为HCC免疫治疗的潜在生物标志物。
总的来说,研究揭示了LTA4H缺乏驱动HCC进展的关键机制,并指出抗TGF-β抗体治疗有望提高LTA4H低表达患者对ICI治疗的反应,强调了LTA4H作为ICI反应生物标志物的潜力。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


