Genome Biology:魏文胜团队实现长期、高效和精准的RNA碱基编辑
来源:生物世界 2023-10-30 14:09
结合研究者在非人灵长类动物和人源化小鼠中的研究结果,LEAPER 2.0 为遗传性疾病治疗以及其他严重疾病的潜在临床应用提供了巨大的希望。
RNA碱基编辑作为一项全新的疾病治疗策略,越来越受到广泛关注。ADAR作为一种细胞内源的RNA脱氨酶已经被广泛应用于RNA碱基编辑。基于ADAR的RNA编辑利用了细胞翻译机制的一个独特性质,即由于结构相似性,肌苷会被识别为鸟嘌呤。这使得ADAR编辑器能够引入特定位点的、由RNA引导的腺嘌呤到肌苷(A-to-I)的改变,从而打开了广泛的治疗潜力,包括修正致病突变、调节基因表达或改变蛋白质相互作用等。
2019年,北京大学魏文胜课题组在 Nature Biotechnology 发表论文【1】,报导了新型RNA编辑技术LEAPER。与以CRISPR为基础的DNA或者RNA编辑技术不同,LEAPER仅需要在细胞中表达特殊设计的RNA(ADAR-recruiting RNA,arRNA)即可招募细胞中内源脱氨酶ADAR,实现靶向目标RNA中腺苷A→肌苷I(鸟苷G)的编辑。
2022年,魏文胜课题组在 Nature Biotechnology 期刊发表论文【2】,升级了LEAPER 2.0,通过设计并运用可招募ADAR的环形RNA(circular ARAR-recruiting RNA, circ-arRNA),实现了RNA编辑效率大幅提升,并显著降低了脱靶效应,提高了编辑精准度。
由于LEAPER是一种依赖于内源ADAR活性的编辑系统,而不同组织和物种中内源 ADAR 的表达存在差异,并且递送方法尚未得到全面验证,因此该技术仍需在多个物种,特别是非人灵长类中进行测试。
2023年10月23日,魏文胜课题组在 Genome Biology 期刊发表了题为:Utilizing AAV-mediated LEAPER 2.0 for programmable RNA editing in non-human primates and nonsense mutation correction in humanized Hurler syndrome mice 的研究论文【3】。
在这项研究中,研究团队进一步利用腺相关病毒(AAV)将工程化的环状ADAR招募RNA(circ-arRNA)递送到非人灵长类动物及人源化小鼠体内,实现了长期、高效和精准的RNA碱基编辑。

首先,研究团队在非人灵长类动物的体外培养细胞内进行了实验,通过优化获得了高效且精准的工程化circ-arRNA,其靶向位点的编辑效率可高达47%。随后,他们将该工程化circ-arRNA包装到AAV病毒载体中,成功实现了在非人灵长类动物体内的递送。
然而,临床上使用的AAV剂量一旦超过1×10E14 vg/kg,会带来严重毒,因此该研究将AAV剂量控制在临床可接受的范围内,分别为3×10E12,1×10E13和3×10E13 vg/kg的剂(图1A)。将这三种剂量的肝靶向AAV8注射到非人灵长类动物体内,并进行长期观察和检测,结果显示在第二周,肝脏细胞编辑效率可达50%以上(图1B)。通过计算感染效率(图1C)发现,受AAV感染的肝脏细胞编辑效率可高达80%,这表明LEAPER 2.0可以在体内快速且高效地发挥作用。
此外,研究团队还发现,编辑效率呈剂量依赖性,随着AAV8剂量的升高,非人灵长类动物体内工程化circ-arRNA的表达量增加,从而提高了编辑效率,这表明LEAPER 2.0具有良好的药物剂量依赖性(图1D)。编辑效率在非人灵长类动物体内可以维持13周并保持稳定,说明通过AAV递送的LEAPER 2.0具有长期编辑的特点(图1E)。此外,研究中未观察到LEAPER 对非人灵长类动物具有毒性,表明了该编辑技术是安全且特异的。
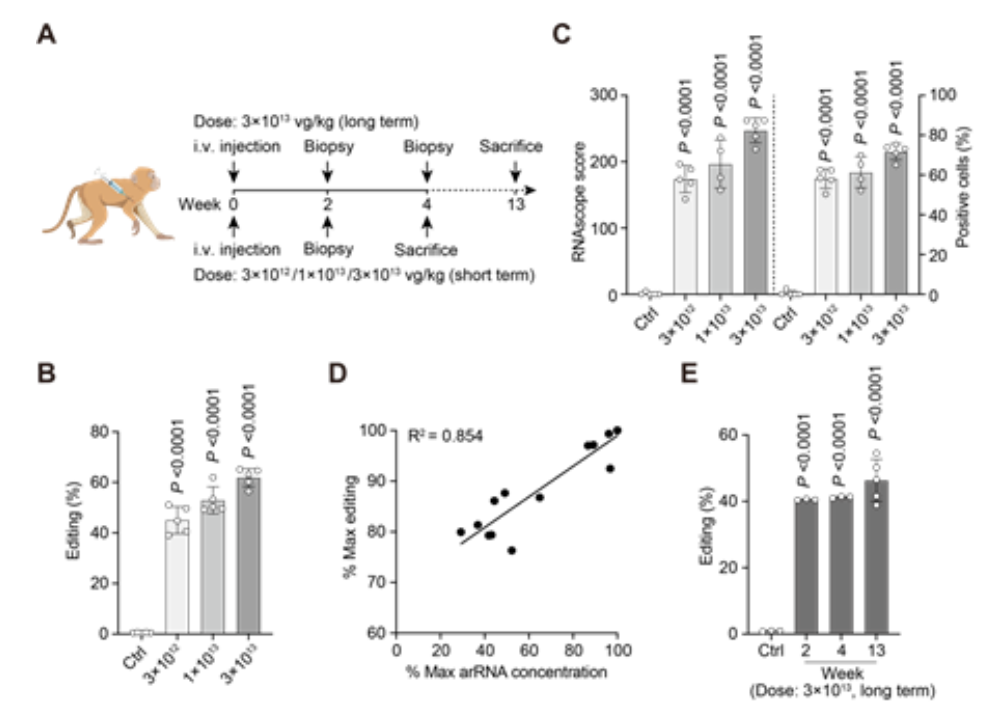
图1. AAV递送的LEAPER 2.0在非人灵长类动物体内实现高效、长时程编辑
进一步地,研究团队尝试使用AAV递送的LEAPER 2.0来治疗人源化转录本中的提前终止密码子。提前终止密码子导致了11%的人类遗传病,因此针对此类密码子的编辑具有巨大的应用前景。
为此研究团队构建了人源化的Hurler综合征小鼠,该小鼠表达人源化的IDUA转录本,其中存在一个提前终止密码子,导致该小鼠可以模拟人类溶酶体贮积症,即粘多糖贮积症 I 型 (MPS-I)(图2A)。MPS-I的特征是α-L-艾杜糖苷酶的酶活性缺陷,导致糖胺聚糖 (GAG)的积累。通过筛选和理性设计,研究团队成功地提高了ADAR编辑的精确性,并获得了高效的工程化circ-arRNA。使用AAV-PHP.eB递送circ-arRNA到小鼠体内,不仅在肝脏等器官,而且在神经系统恢复了α-L-艾杜糖苷酶的酶活性(图2B,C),降低了GAG的积累,显著改善了小鼠的表型。
由于目前MPS-I的治疗策略多为酶替代疗法,递送的IDUA蛋白不能跨越血脑屏障,因此无法治疗中枢神经系统中的GAG积累,而LEAPER 2.0介导的RNA编辑能够在多个器官中恢复细胞内源IDUA转录本的功能,从而实现了更优的治疗效果。
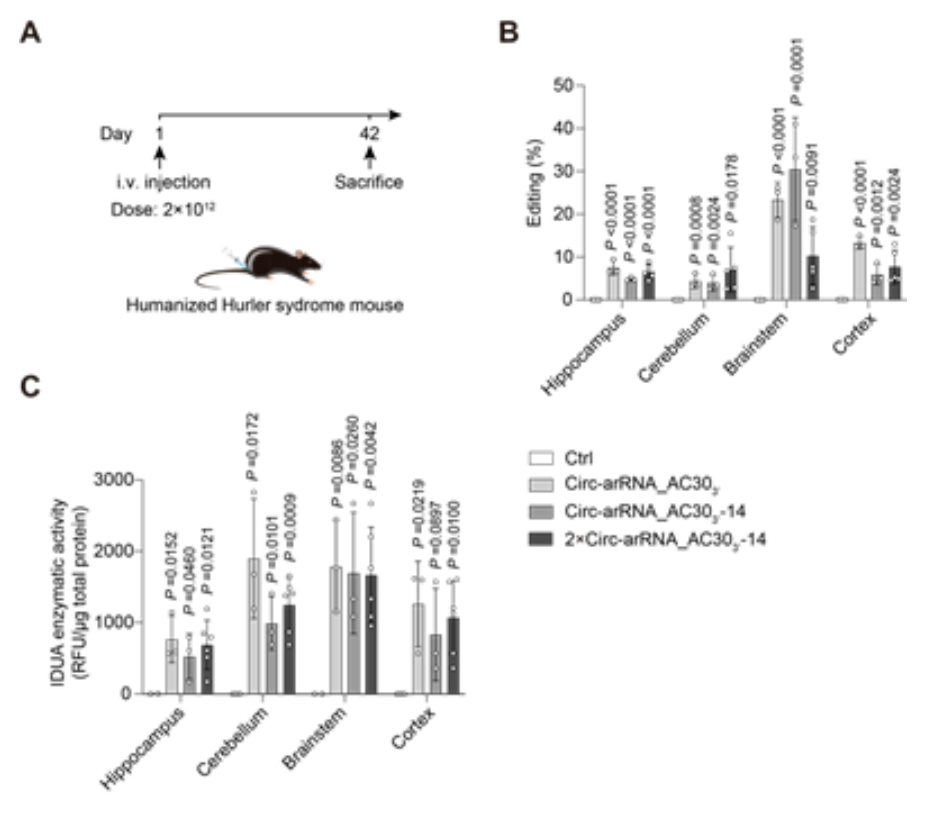
图2. AAV递送的LEAPER 2.0成功治疗人源化Hurler综合征小鼠
结合研究者在非人灵长类动物和人源化小鼠中的研究结果,LEAPER 2.0 为遗传性疾病治疗以及其他严重疾病的潜在临床应用提供了巨大的希望。这些发现极大地加强了通过AAV递送的工程化环状ADAR招募RNA用于治疗和探索性转化研究的前景。
这项研究由博雅辑因生物科技有限公司和北京大学魏文胜课题组合作完成。博雅辑因科学创始人、北京大学魏文胜教授和博雅辑因袁鹏飞博士为该论文共同通讯作者。魏文胜课题组伊宗裔博士、博雅辑因赵艳霞博士、易泽轩博士和张永建博士为论文的共同第一作者,博雅辑因汤刚彬博士等人也对这项研究作出了重要贡献。该研究项目得到了国家重点研发计划、国家自然科学基金重点项目、北京市科委生物医学前沿创新推进项目、北大-清华生命科学联合中心、昌平实验室和中国博士后科学基金的支持
论文链接:
1. https://www.nature.com/articles/s41587-019-0178-z
2. https://www.nature.com/articles/s41587-021-01180-3
3. https://genomebiology.biomedcentral.com/articles/10.1186/s13059-023-03086-6
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


