蔡宇伽/洪佳旭团队开发基于病毒样颗粒的新型基因编辑递送工具,为亨廷顿病治疗带来新希望
来源:生物世界 2025-02-12 10:13
研究团队表示,RIDE 系统的成功开发为亨廷顿舞蹈症的治疗带来了新希望,并有望在未来应用于其他神经退行性疾病和遗传性疾病的治疗。
上海交通大学蔡宇伽团队联合复旦大学眼耳鼻喉科医院洪佳旭及阿斯利康 Pinar Akcakaya 团队,在 Nature Nanotechnology 期刊发表了题为:Customizable virus-like particles deliver CRISPR-Cas9 ribonucleoprotein for effective ocular neovascular and Hungtington's disease gene therapy 的研究论文。
该研究开发了一种新型基因编辑递送工具——RIDE(Ribonucleoprotein delivery)。该技术通过类病毒颗粒(Virus-like particle,VLP)递送 CRISPR/Cas9 核糖核蛋白(RNP),实现了神经元细胞特异性的基因编辑,为亨廷顿舞蹈症病等难治性疾病的治疗提供了全新思路。

研究团队开发的 RIDE 系统通过将 CRISPR/Cas9 RNP 封装在病毒样颗粒(VLP)中,实现了细胞类型特异性的基因编辑递送。在编辑效率上,RIDE 展现了与传统的慢病毒载体递送系统不相上下的编辑效率,但具有瞬时性存在、脱靶风险低的特点,体现了在基因编辑治疗中的优势。RIDE 递送的 CRISPR/Cas9 工具能够精确靶向 HTT 基因,成功在小鼠和非人灵长类动物中实现了高效的基因编辑。在亨廷顿舞蹈症小鼠模型中,通过敲除 CAG 重复序列,降低突变亨廷顿蛋白的表达,显著改善了疾病症状。
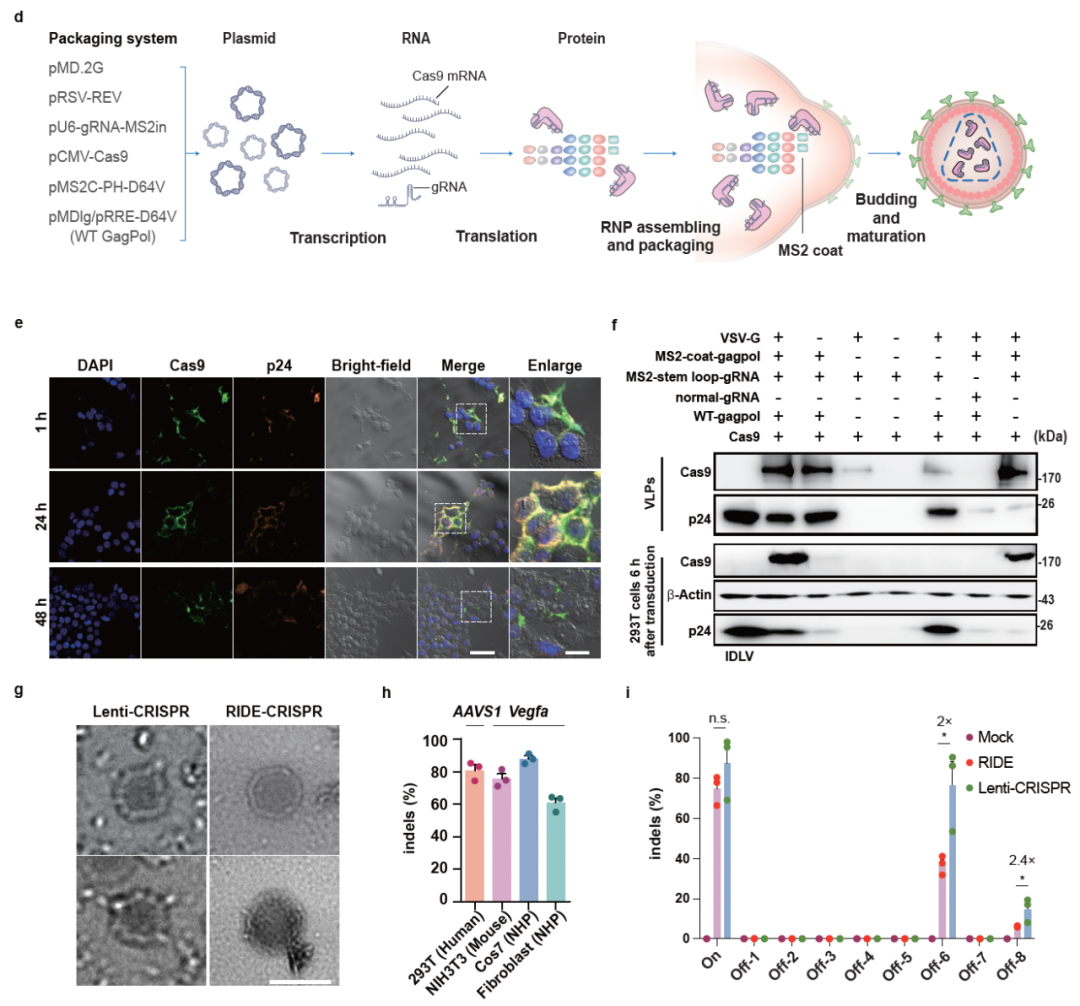
RIDE原理与体外特征研究
研究团队证实了 RIDE 在神经元中的特异性递送能力,且未引发显著的免疫反应、细胞毒性或脱靶效应。在非人灵长类动物的安全性评估中,研究团队通过磁共振成像(MRI)和血清生化指标分析,证实了 RIDE 在脑部注射后未引发明显的组织损伤或系统性毒性。
进一步的免疫相关基因表达分析显示,RIDE 注射后仅轻微上调了 IL-6 和 IL-1β 的表达,未引发显著的炎症反应。这些结果表明,RIDE 在非人灵长类动物中具有良好的安全性和耐受性,为其未来的临床转化打下了基础。此外,RIDE 在亨廷顿病患者来源的诱导多能干细胞(iPSC)衍生的神经元中也表现出高效的基因编辑能力且脱靶效应极低,进一步支持了其临床应用的潜力。
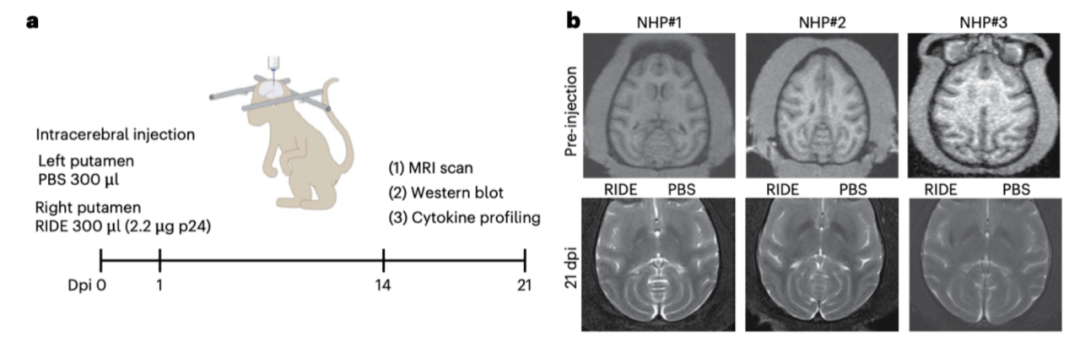
非人灵长类安全性研究
值得注意的是,在眼科模型中,研究团队通过单细胞 RNA 测序发现,即使在“免疫豁免”的眼睛中,基因治疗也可能会触发免疫细胞侵润。这表明了瞬时递送基因编辑酶的重要性,因为长期的外源基因编辑酶表达可能招致免疫细胞的攻击。的确,即使是在存在免疫细胞侵润的情况下,RIDE 也未引起明显的细胞凋亡和神经功能损伤。这一发现进一步支持了 RIDE 系统的安全性,为未来在 Cas9 免疫阳性人群中的基因编辑治疗提供了可能。
此外,这项研究的创新之处还在于 RIDE 系统不仅能够实现神经元细胞特异性的基因编辑递送,还能通过工程化的病毒包膜蛋白进行靶向性重编程,靶向树突状细胞等其它细胞类型。这一特性使得 RIDE 在治疗其他遗传性疾病和复杂疾病方面具有广泛的应用前景。
研究团队表示,RIDE 系统的成功开发为亨廷顿舞蹈症的治疗带来了新希望,并有望在未来应用于其他神经退行性疾病和遗传性疾病的治疗。随着进一步的研究和临床试验,RIDE 有望成为基因编辑领域的重要工具,助力基因治疗的发展和普及。
蔡宇伽为该论文最后通讯作者,洪佳旭为共同通讯作者,蔡宇伽团队的凌思凯、张雪、戴瑶、姜卓凡以及洪佳旭团队的周旭娇为论文共同第一作者。阿斯利康的 Pinar Akcakaya 等均为该研究的完成做出了重要贡献。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


