铁死亡+免疫治疗双杀!JIB04 逆转胰腺癌“冷肿瘤”属性,J Immunother Cancer 揭秘表观调控新路径
来源:生物谷原创 2025-11-25 10:34
本研究搭建胰腺癌患者来源类器官-自体T细胞共培养平台,发现JIB04可表观抑制Nrf2–Slc40a1轴诱导肿瘤铁死亡,转化冷肿瘤微环境,增强抗PD-1疗效,为胰腺癌免疫治疗提供新策略。
胰腺癌尤其是胰腺导管腺癌(PDAC),一直是免疫治疗领域的“硬骨头”——患者对免疫检查点阻断治疗的响应率极低。这背后的关键问题,在于胰腺癌存在严重的免疫抑制性肿瘤微环境,且CD8+T细胞浸润量不足,使得胰腺癌成为典型的“免疫冷肿瘤”。
近日,J Immunother Cancer发表了一项研究Epigenetic suppression of Nrf2-Slc40a1 axis induces ferroptosis and enhances immunotherapy in pancreatic cancer不仅解决了胰腺癌免疫治疗药物筛选的平台难题,还找到了能有效改善治疗效果的表观遗传药物,为临床突破带来新希望。

研究团队聚焦于抗PD-1治疗无响应的PDAC患者,采用内镜超声引导细针穿刺(EUS-FNA)获取肿瘤标本,成功搭建了患者来源类器官(PDO)-自体T细胞共培养的高通量药物筛选平台。这个平台的优势很突出:类器官构建成功率达75%,能精准复刻原发肿瘤的组织病理特征,而且从类器官建立到完成药物筛选仅需1个月,完全符合临床转化的时效性需求。通过对177种表观遗传化合物的筛选,研究人员发现组蛋白去甲基化酶抑制剂JIB04表现最优——当它与抗PD-1治疗联用时,在PDO-T细胞共培养体系中能产生最强的协同作用,显著增强T细胞对肿瘤类器官的细胞毒性。
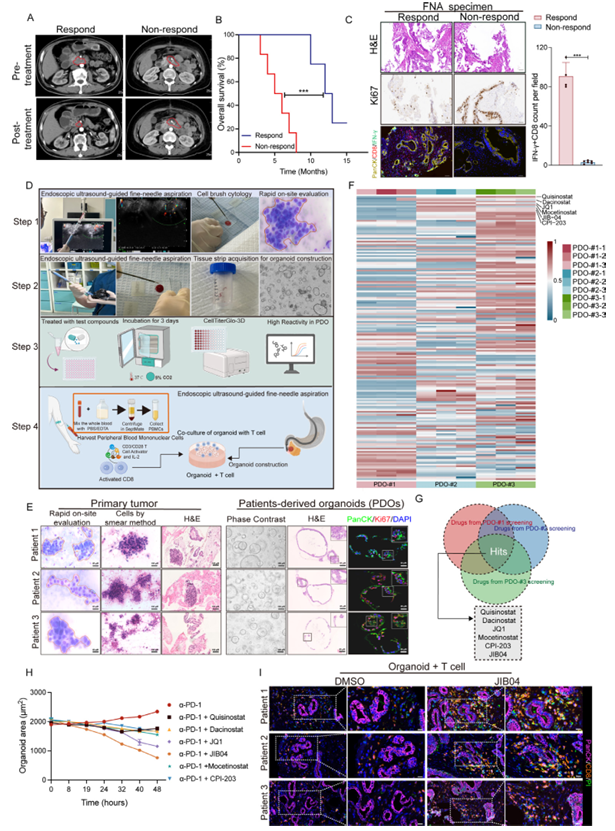
图1:基于类器官平台的表观药物筛选
为验证JIB04的治疗效果,研究团队开展了体内外实验。体外实验显示,JIB04能剂量依赖性降低PDO中Ki67的表达量,同时诱导肿瘤细胞死亡;更关键的是,它对正常胰腺类器官的半数抑制浓度远高于肿瘤类器官,说明其对肿瘤细胞有选择性毒性,不会损伤正常组织。在小鼠原位胰腺癌模型中,JIB04的表现同样亮眼:不仅显著减少肿瘤负荷、降低肿瘤重量,还能延长荷瘤小鼠的生存期。而且整个治疗过程中,小鼠的体重、血常规、肝肾功能均无异常,主要器官也未出现病理损伤,充分证实了JIB04的体内安全性。
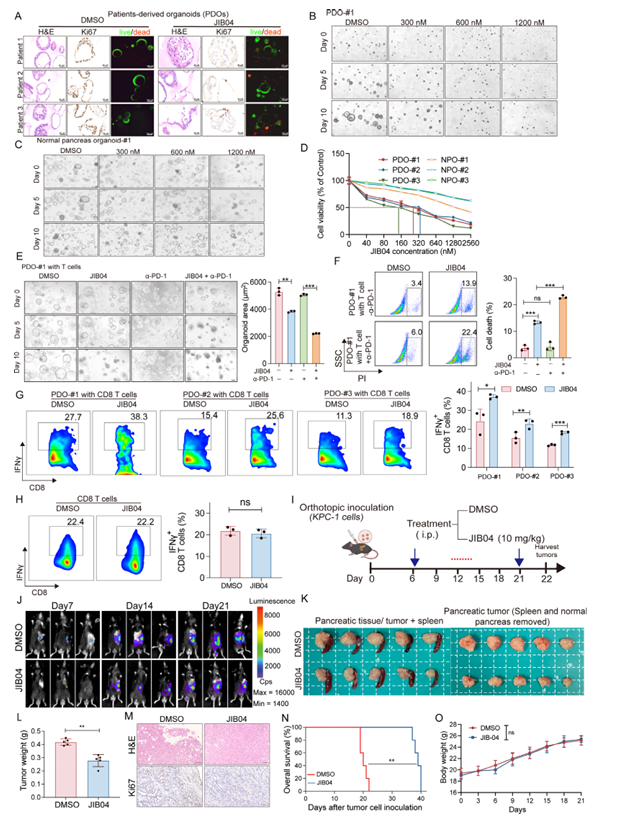
图2:JIB04处理增强PDO中T细胞的细胞毒性并调控体内胰腺肿瘤生长
为弄清JIB04的作用机制,研究团队通过ATAC-seq和转录组测序分析发现,JIB04会大幅降低肿瘤细胞染色质的可及性,且差异表达的基因主要集中在铁离子转运、活性氧代谢和免疫细胞迁移相关通路。进一步实验证实,JIB04能下调核因子E2相关因子2(Nrf2)的表达,同时减少其下游铁输出蛋白Slc40a1远端调控区域的染色质可及性。这种调控会直接阻碍肿瘤细胞的铁外流,导致细胞内铁离子不断累积,最终触发铁死亡——实验中能清晰观察到,JIB04处理后肿瘤细胞出现脂质过氧化水平升高、丙二醛(MDA)含量增加、线粒体皱缩等典型的铁死亡特征,而铁死亡抑制剂去铁胺(DFO)能完全逆转这些效应。
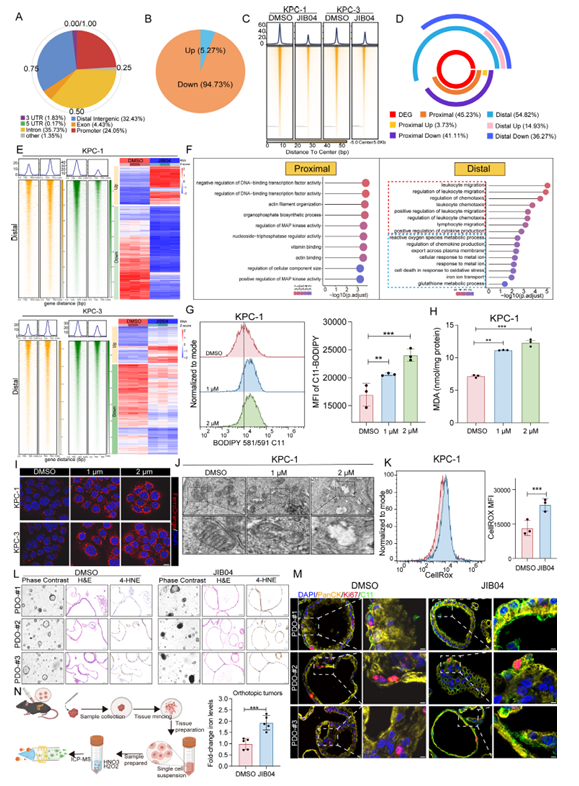
图3:JIB04通过调控染色质可及性诱导铁死亡
研究还明确了Nrf2–Slc40a1轴在铁死亡中的核心作用:过表达Nrf2或Slc40a1,都能显著降低JIB04诱导的脂质过氧化水平;而且通过ChIP-qPCR实验证实,Nrf2能直接结合到Slc40a1的远端调控区域,是Slc40a1的上游调控因子。这一发现,彻底厘清了JIB04诱导铁死亡的分子路径。
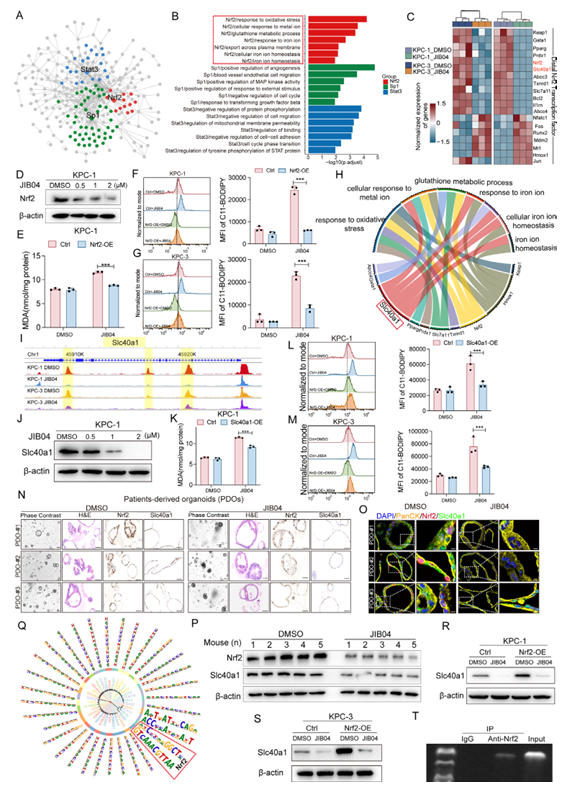
图4:JIB04介导的Nrf2抑制通过下调靶基因诱导铁死亡
更重要的是,JIB04诱导的肿瘤铁死亡还能重塑肿瘤免疫微环境。一方面,发生铁死亡的肿瘤细胞会释放高迁移率族蛋白1(HMGB1)、钙网蛋白(CRT)等损伤相关分子模式,这些分子能激活免疫反应;另一方面,JIB04处理后,肿瘤组织中CD8+T细胞的浸润比例和绝对数量显著增加,而且这些CD8+T细胞分泌IFNγ的能力也大幅提升,直接将胰腺癌的“免疫冷微环境”转化为“免疫热微环境”。值得注意的是,用DFO阻断铁死亡后,JIB04对CD8+T细胞浸润的促进作用会消失,这说明铁死亡是调控免疫微环境的关键环节。
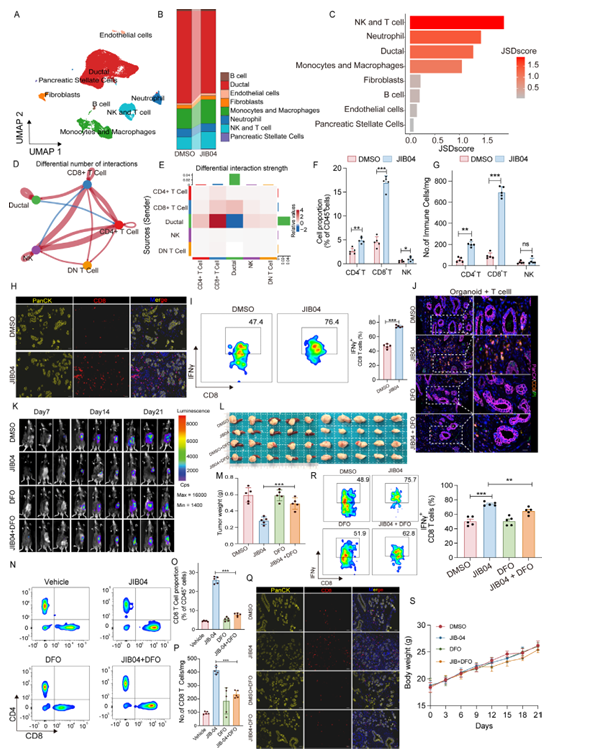
图5:JIB04通过肿瘤细胞铁死亡促进CD8+T细胞浸润
在联合治疗实验中,JIB04与抗PD-1治疗联用的效果更显著:不仅能进一步抑制肿瘤生长,还能让CD8+T细胞的浸润和活化水平再上一个台阶。临床样本分析也给出了重要提示——对PD-1治疗响应良好的PDAC患者,其肿瘤组织中Nrf2和Slc40a1的表达量更低,CD8+T细胞浸润更丰富,这意味着Nrf2和Slc40a1有望成为预测PD-1治疗疗效的生物标志物。
这项研究的意义不止于建立了适用于晚期胰腺癌患者的精准药物筛选平台,更关键的是找到了JIB04这一潜在治疗药物,并阐明了它通过表观调控Nrf2–Slc40a1轴诱导铁死亡、重塑免疫微环境的机制。这不仅为胰腺癌免疫治疗提供了新的候选药物和作用靶点,更让临床医生看到了将“免疫冷肿瘤”转化为“热肿瘤”的可行路径。未来随着临床转化研究的推进,有望为更多难治性胰腺癌患者带来新的治疗希望。(生物谷Bioon.com)
参考文献:
Zhang Y, Yu R, Li Q, et al. Epigenetic suppression of Nrf2-Slc40a1 axis induces ferroptosis and enhances immunotherapy in pancreatic cancer. J Immunother Cancer. 2025;13(10):e013269. Published 2025 Oct 23. doi:10.1136/jitc-2025-013269
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


