马竞/郝冰涛/马端/黄国英团队揭示黏连蛋白复合体在心脏发育中的作用机制
来源:生物世界 2024-08-03 10:02
在这项最新研究中,研究团队阐明了SMC3在心脏发育中的重要性,它通过调控包含超级增强子(SE)的特定空间染色质结构,有效地控制了对心脏发生至关重要的主控基因的表达。
复旦大学马竞研究员、马端教授、黄国英教授及郑州大学郝冰涛教授团队(复旦大学博士生张博文、郑州大学博士生朱永常为论文共同第一作者)在 Nature 旗下期刊 Experimental & Molecular Medicine 上发表了题为:SMC3 contributes to heart development by regulating super-enhancer associated genes 的研究论文。
该研究揭示了黏连蛋白(Cohesin)成分相关基因SMC3通过调控超级增强子(SE)相关基因参与心脏发育,确立了SMC3与先天性心脏病(CHD)之间的关联,并为心脏发育的分子基础提供了关键见解。

许多超级增强子(SE)与它们所调控的基因在位置上相距较远,并常常通过由黏连蛋白(Cohesin)介导的染色质环来调节其靶基因。黏连蛋白是一种呈环形的蛋白质复合物,起着“染色质胶水”的作用,由NIPBL加载到染色质上,通过DNA挤出形成染色质环,将远端的超级增强子与启动子连接起来以协调基因表达。
科妮莉亚·德·朗格综合征(CdLS)是一种罕见遗传疾病,由编码黏连蛋白成分的基因发生突变引起,包括NIPBL(65%)、HDAC8(8%)、SMC1A(5%)和SMC3(1–2%)。值得注意的是,相当比例的CdLS患者还表现出先天性心脏病(CHD),这对发病率和死亡率有显著影响。
对模型动物心脏表型的分析表明,NIPBL缺乏会导致与黏连蛋白病相关的心脏缺陷。通过在小鼠胚胎的不同心脏细胞谱系中表达Cre酶构建的Nipbl杂合小鼠模型,由于细微的全局转录失调,高频出现先天性心脏畸形——房间隔缺损(ASD)。Nipbl敲低的斑马鱼在异常内胚层发育的情况下表现出心脏缺陷。然而,黏连蛋白缺陷导致先天性心脏病的详细机制仍不清楚,特别是在涉及其他黏连蛋白成分的基因突变的情况下。
在这项最新研究中,研究团队阐明了SMC3在心脏发育中的重要性,它通过调控包含超级增强子(SE)的特定空间染色质结构,有效地控制了对心脏发生至关重要的主控基因的表达。
具体来说,研究团队发现,患有SMC3突变的CdLS患者的先天性心脏病(CHD)的发生率很高。研究团队利用心脏特异性Smc3基因敲除(SMC3-cKO)小鼠,这些小鼠表现出不同程度的心室流出道异常,以进一步探索这种关系。
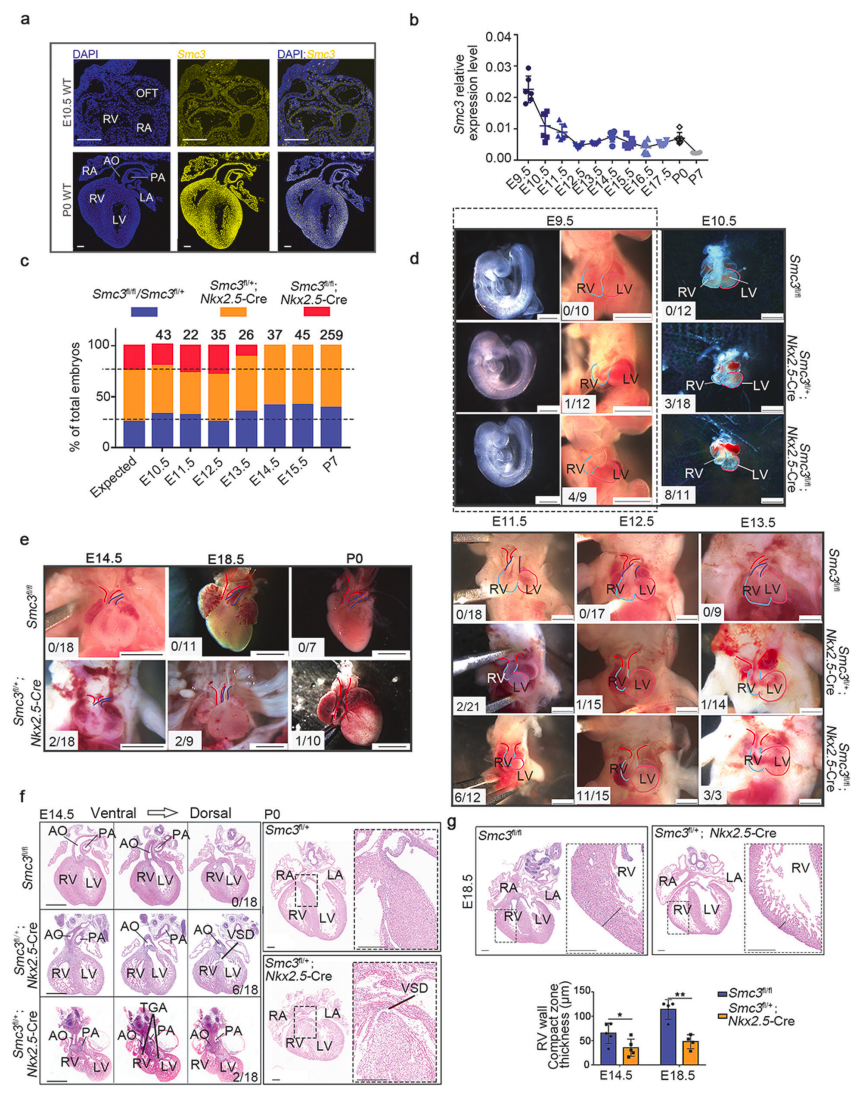
心脏特异性Smc3基因敲除小鼠的心室流出道缺陷
此外,研究团队还在患有孤立性先天性心脏病的患者中鉴定出16种具有潜在致病性的罕见SMC3基因突变,其表型与在SMC3-cKO小鼠中观察到的相似。
通过采用单核RNA测序和染色体构象捕获高通量全基因组易位测序,研究团队揭示了Smc3缺失通过特异性减少超级增强子(SE)与启动子之间的相互作用,下调了心室流出道心肌细胞中包括Ets2在内的关键基因的表达。值得注意的是,Ets2-SE缺失小鼠的心脏中心室流出道发育也出现延迟。
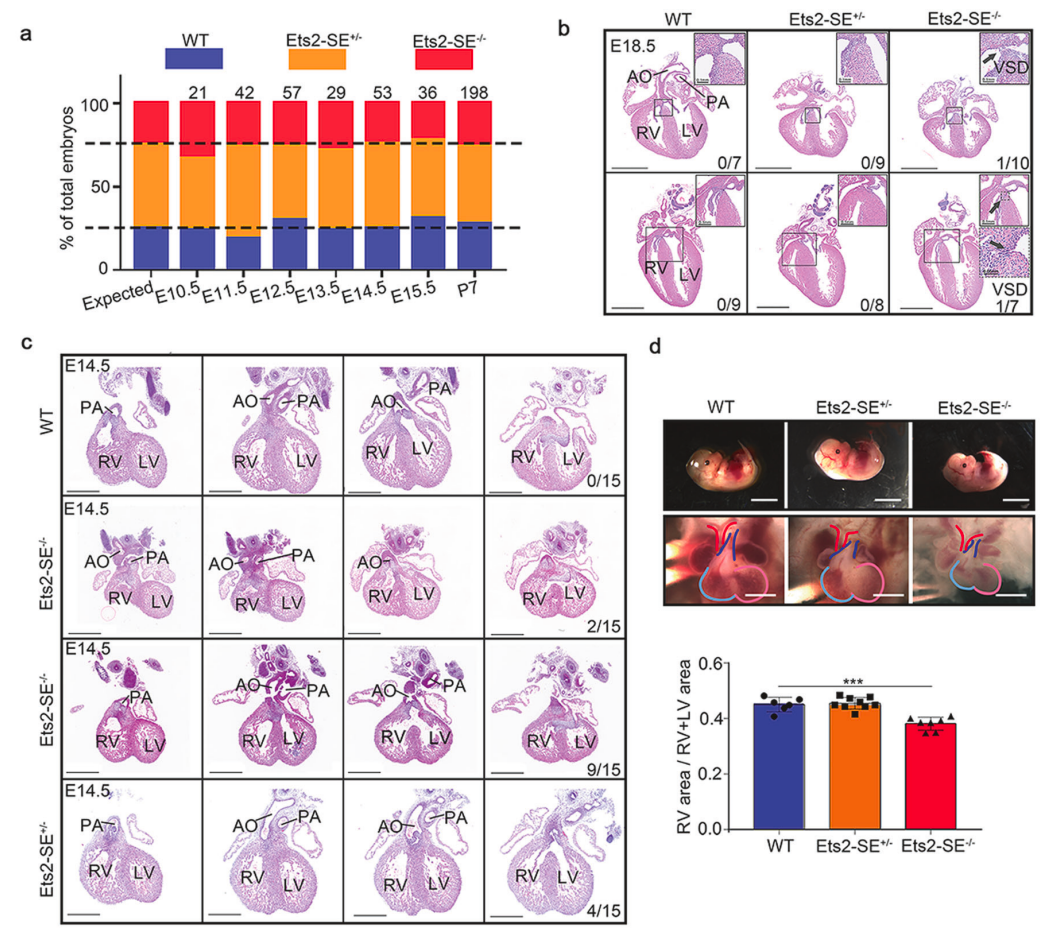
Ets2超级增强子缺失延迟了小鼠心室流出道的发育
总的来说,该研究揭示了SMC3通过调控超级增强子(SE)相关基因在心脏发育中的新作用,表明了SMC3在心脏发育中的重要功能,确立了SMC3与先天性心脏病(CHD)之间的关联,并为心脏发育的分子基础提供了关键见解。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


