HER2阳性乳腺癌患者终于迈入更轻盈自在的治愈之路
来源:奇点糕 2023-12-21 10:35
19世纪末,乳腺癌还被认为是一种无可争议的绝症。而一百多年后的今天,早期诊断的HER2阳性乳腺癌患者有极大概率获得和正常人一样的预期寿命。
19世纪末,乳腺癌还被认为是一种无可争议的绝症。而一百多年后的今天,早期诊断的HER2阳性乳腺癌患者有极大概率获得和正常人一样的预期寿命。
如果我们把自己想象成一个时间旅行者,穿越时空去回看这一百多的风云巨变,就会领略到那些伟大生命接力背后的科学之美。
「少即是多」——从大刀阔斧到精雕细琢
1894年,现代外科手术的先驱之一,约翰霍普金斯医院的William Halsted医生发表了一篇改变乳腺癌外科历史的论文。在这篇文章中,他详细描述了一种开创性的乳腺癌外科根治术[1]。
Halsted医生用这种术式治疗的50名患者中,仅有3名出现了局部复发,而被记录的同期其他手术复发率在50%~85%。著名的Halsted根治术由此诞生。在此后约80年时间里,Halsted根治术几乎一直独霸江湖。1970年代的时候,美国超过90%的乳腺癌手术仍然采用Halsted根治术[2]。
从现在看来,Halsted根治术非常激进,甚至让人觉得毛骨悚然。手术不但会切除乳房,清除腋窝淋巴结,还会切除胸大肌和胸小肌。之所以要如此大刀阔斧,是因为当时科学界认为,癌细胞会进行连续的局部扩散,从乳房到周围的肌肉和淋巴组织。
在这期间,Patey,Madden等人先后对Halsted根治术做了改进,保留了胸大肌,但对于乳腺癌的认知范式并没有太大改变[3]。直到接力棒传给了美国匹兹堡大学外科医生Bernard Fisher。
Fisher医生认为,癌细胞并没有那么听话,会有序地沿着身体解剖结构有序传播,它们极有可能在疾病早期就通过血液传播到了全身,因此激进的局部治疗并不能给患者带来长期的生存获益。
为了验证这个假设,Fisher医生在1971年开展了足以载入史册的NSABP B-04研究。NSABP B-04研究在腋窝淋巴结阴性和阳性的两组患者中,分别使用乳腺癌根治术、乳腺单纯切除+术后放疗、乳腺单纯切除治疗,评估患者的局部复发率和长期生存获益。
这项研究的25年随访结果显示,两组患者中各亚组在无病生存,无远处转移生存,以及总生存方面没有统计学差异[4]。也就是说,不管是对于腋窝淋巴结阳性还是阴性的患者,激进的乳腺癌根治术都没有给患者带来更多生存获益。
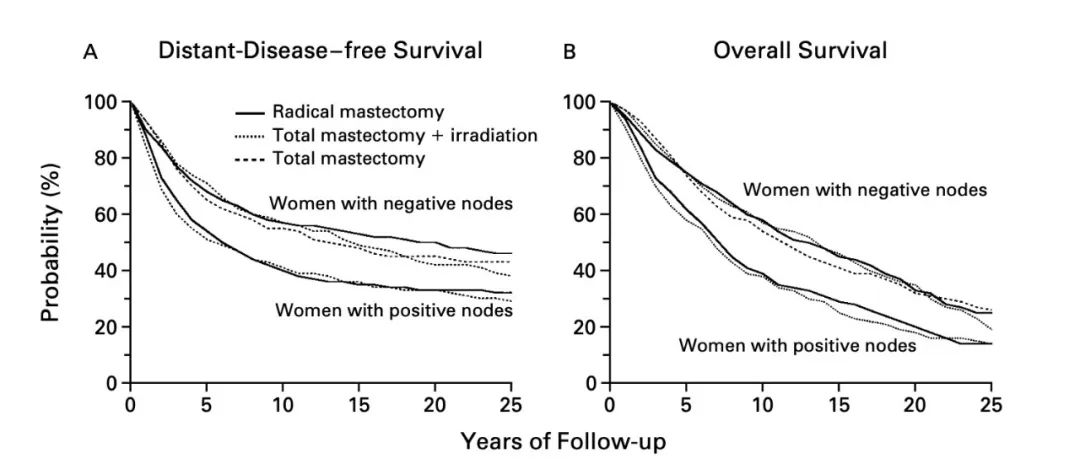
NSABP B-04研究25年随访显示,无远处转移生存,以及总生存方面没有统计学差异
大刀阔斧会伤及无辜,精雕细琢才是未来。乳腺癌外科治疗由此迈入了「少即是多」的时代。
此后,著名的意大利的Milan研究[5]、美国的NSABP B-06研究[6],等一系列大型随机对照研究开始探索保乳手术与切乳手术的生存获益。几项大型研究的长期随访结果均显示,对于符合一定条件的早期乳腺癌患者,象限切除术或肿块切除术对比全乳切除术,患者的长期OS无明显差异。保乳手术由此开始风靡。
外科手术的减法还在继续,保乳之后的另一场战役是保腋窝。
我们知道,腋窝淋巴结清扫具有严重的潜在并发症。大量荟萃分析显示,腋窝清扫术后,患者出现上肢淋巴水肿的平均概率高达16.6%[7],严重影响患者的生活质量。1994年,Giuliano医生首次将前哨淋巴结活检技术应用于乳腺癌患者的术中检查[8]。
后续的ACOSOG Z0011研究显示,满足一定条件,前哨淋巴结中有1~2个转移的患者,接受前哨淋巴结清扫与接受腋窝淋巴结清扫,在10年总生存方面没有差异[9]。前哨淋巴结活检的成功应用,使 60%~75% 的腋窝淋巴结阴性患者免于淋巴结清扫术,对患者意义非凡。
极致的减法还在继续,目前有众多研究正在探索,是否可以让新辅助治疗后获得pCR的患者完全豁免手术。
无惧「女性杀手」,迈向慢病时代
2019年的拉斯克临床医学研究奖,颁给了在曲妥珠单抗研发中厥功至伟的三位科学家。HER2阳性乳腺癌的征服之旅正是由他们开启。
1998年,作为全球首款治疗实体瘤的单抗类药物,曲妥珠单抗的上市随即改写了HER2阳性晚期乳腺癌的治疗格局。此后,抑制HER2二聚化的药物帕妥珠单抗也惊艳亮相,由此开启了曲帕(PH)双靶的王者之路。
双靶强强联合的第一站是针对晚期患者。大名鼎鼎的CLEOPATRA试验8年随访数据显示[10],PH双靶联合化疗可使患者中位生存期飞跃至57.1个月,显著优于曲妥珠单抗联合化疗的40.8个月,两组8年总生存率分别为37%和23%。
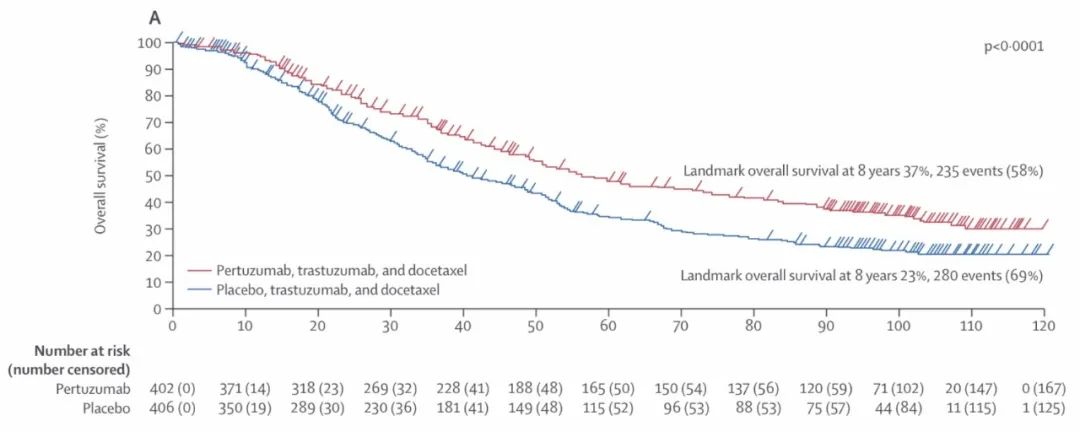
将近5年的中位生存期,约三分之一的患者生存超过8年,HER2阳性晚期乳腺癌患者从预后极差的魔咒中走出,迈入了慢病时代。
如果晚期疾病的治疗目标是迈入慢病,那么早期疾病的治疗目标,就是直达治愈。
PH双靶早期治疗的首次惊艳亮相是在2012年,新辅助研究NeoSphere主要结果公布,PH双靶联合多西他赛治疗的tpCR(总病理学缓解)率高达39.3%,几乎是曲妥珠单抗(H)单靶+多西他赛数据(21.5%)的翻倍[11]。
此后主打中国人群的PEONY研究也复刻了NeoSphere的杰出战绩,PH双靶联合化疗组取得了39.3%的tpCR率[12]。而随后的TRYPHAENA、BERENICE等研究,也验证了PH双靶联合不同的化疗药物,给予不同周期数治疗均能取得惊艳的效果[13~14]。
新辅助治疗不是终点,对于高风险患者,辅助治疗是巩固治疗成果,预防术后复发的有力武器。PH双靶辅助治疗的关键性研究APHINITY主要结果在2017年亮相[15]。研究结果显示,与H单靶联合化疗相比,PH双靶联合化疗可以将患者的复发/死亡风险降低19%,淋巴结阳性组患者iDFS风险降低23%,绝对获益1.8%。
2022 年 ESMO 大会上,APHINIPY 研究8.4年随访结果公布,结果显示,PH双靶联合化疗组8年总生存期高达92. 7%[16],真正开启了「愈她」之旅。
扫尽阴霾,轻松「愈她」
从外科手术的「少即是多」,到抗HER2单抗治疗的「愈她」之旅,HER2阳性乳腺癌治疗在近一百年里打赢了一场漂亮的生存之战。
解决了生存问题之后,我们自然要开始真正关注一个个女性患者面临的生活挑战。由于单抗类药物需要静脉输注,她们需要花时间和精力频繁地往返医院接受治疗,也需要和可能存在的输注并发症周旋,每次长达几个小时的静脉输注流程会一次又一次地将她们拉回到患病的沮丧情绪中。
那么,如果可以将单抗类药物做成皮下制剂,那么患者就可以实现居家治疗,这将会是HER2阳性乳腺癌治疗史的一次重大飞越。
的确,在很长一段时间,将抗肿瘤单抗类药物做成皮下制剂,都是一个疯狂的想法。因为将大分子单抗进行皮下输注面临着一系列重大的挑战,例如如何大剂量/大容积给药,如何提高生物利用度、如何克服免疫原性等等。
最重要的是,皮下单抗输注存在一个天然的悖论。我们知道,皮下组织的天然屏障会将皮下给药剂量限制在2mL以下,超过这个剂量,就会导致患者疼痛。这其实也是我们机体的一种保护机制。但同时抗肿瘤单抗类药物又需要较大的液体量去溶解,如果为了减少注射量,就需要浓缩药物,而浓缩药物又会增加输注时间和疼痛。
破解这一难题的关键角色是透明质酸酶。我们皮下组织中有一种叫透明质酸的凝胶状物质,这种高粘度和高弹性的多糖物质会阻止药物在皮下组织中的扩散。而透明质酸酶则可以分解皮下组织中的透明质酸,提升药物的扩散能力,从而提升输注药物的剂量。
事实上,Duran-Reynals在1920年就首次从动物体内分离出透明质酸酶。但由于存在免疫原性反应,以及纯化分离困难等问题,透明质酸酶的应用一直踌躇不前。直到2005年,重组透明质酸酶(rHuPH20)上市,才真正使单抗类药物的皮下输注破局。
在新型药物递送技术的加持下,2013年,全球首款肿瘤领域皮下单抗类药物,曲妥珠单抗皮下制剂(H-SC)诞生,目前,H-SC已在包括中国在内的全球108个国家/地区获批。
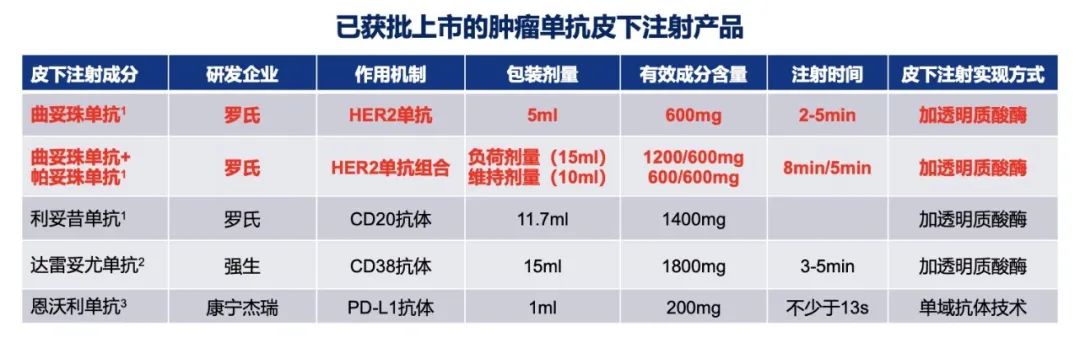
H-SC的给药时间仅需2-5分钟,注射后不易鼓包,且患者治疗没有明显的疼痛感。同时,一系列研究证实,皮下制剂给药后,单抗在体内的分布和清除与患者体重相关性弱,这就使得不同体重的患者可以采用同一固定剂量的皮下制剂,大大方便了患者给药。
当然,H-SC治疗的便捷性,需要杰出的疗效和安全性做保障。目前,多项全球临床试验数据都充分证实了H-SC治疗的安全性和有效性。
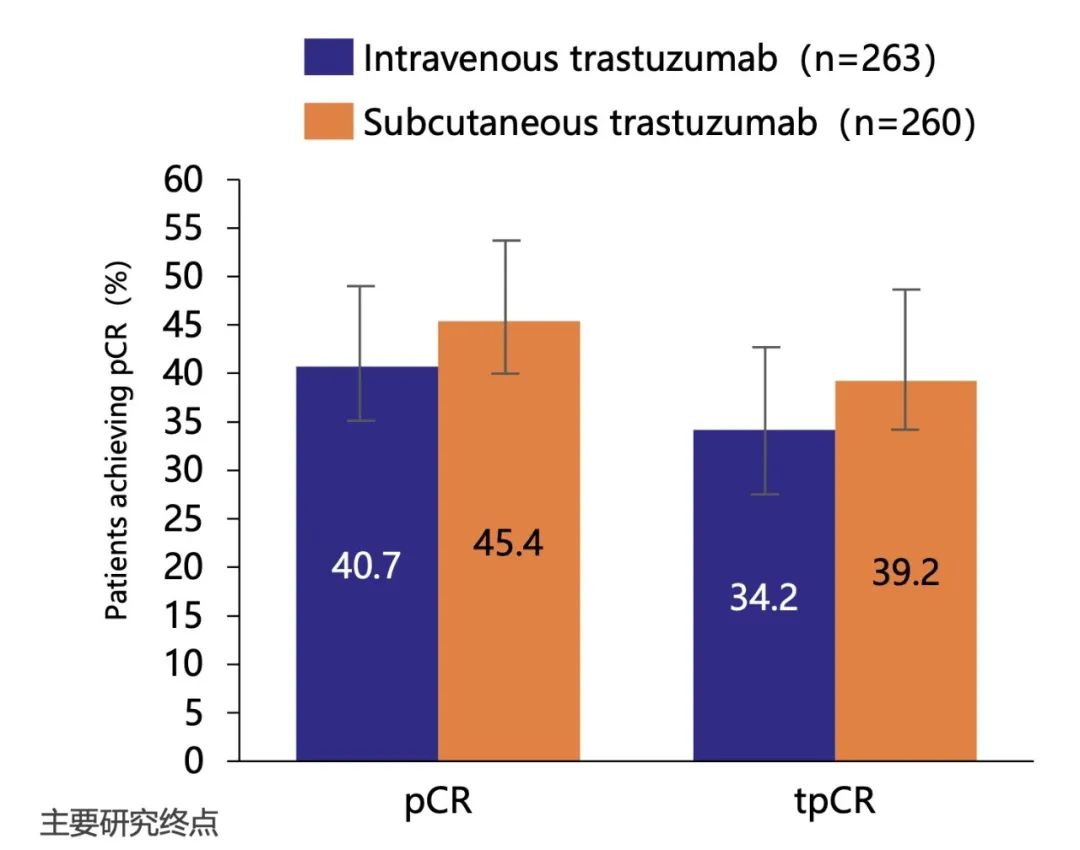
H-SC关键性III期研究 HannaH试验证实,与曲妥珠单抗静脉输注(H-IV)相比,H-SC在PK及pCR结果方面非劣效于H-IV[17]。长期随访结果显示,两组EFS和OS结果相似,安全性特征也一致[18]。HannaH研究亚组分析也证实,H-SC疗效不受体重影响。后续的PrefHER和SafeHER研究进一步显示,H-SC治疗可以节省治疗时间并减少注射疼痛和不适感 ,安全性和耐受性良好[19~20]。
凭借与静脉制剂等效的安全性与疗效,加之出色的治疗体验升级。自H-SC获批以来,各大权威指南均推荐,无论是早期新辅助或辅助阶段,还是晚期阶段,H-SC均可替代曲妥珠单抗静脉制剂[21]。
单靶皮下制剂诞生后,双靶皮下制剂也紧随其后。2020年,PH双靶皮下制剂(PH FDC SC )诞生。FeDeriCa研究证实,PH FDC SC在PK与疗效上与PH IV一致 ,且体重对疗效无影响[22]。随后,FDChina研究在中国人群中也重现了全球研究的结果[23]。
后续PHranceSCa研究进一步提示,在早期治疗中,PH双靶皮下制剂可以与静脉制剂交叉转换,免除了患者换药顾虑[24]。同时,PHranceSCa研究-患者倾向性结果分析显示,85%患者倾向于选择双靶皮下制剂。
在治疗便捷性和经济学角度,PHaTiMa研究则提示,PH双靶皮下制剂可以显著节省患者和医生的时间[25]。药物经济学研究显示,与静脉输注相比,PH双靶皮下制剂可极大减少非药物成本,据估算,在西欧和美国,分别可使非药物成本降低73%-80%和75% [26]。
众多临床研究和真实世界研究均提示,双靶皮下制剂在疗效和安全性方面和静脉注射制剂等效,同时极大节省了患者治疗的时间,提升了治疗体验,并极大降低了非药物经济成本。由此,NCCN指南推荐,帕妥珠单抗+曲妥珠单抗+透明质酸酶三合一皮下注射制剂可以代替静脉制剂用于全身系统治疗[27]。


NCCN指南推荐,帕妥珠单抗+曲妥珠单抗+透明质酸酶三合一皮下注射制剂可以代替静脉制剂用于全身系统治疗
「她」没什么不一样
到这里,我们的时空旅行就要结束了。回看HER2乳腺癌治疗百年来波澜壮阔的历史,外科手术从粗放到精细,从重创到微创,药物治疗从延长生命,到摘得治愈桂冠,一系列的生命接力都展现了医学精进之美。而皮下制剂的诞生,让HER2乳腺癌治疗迈入了一个新纪元,在这个全新的时代,「她」可以重拾自信,重整生活,迎接更轻盈的「愈她」之路。
更轻盈的「愈她」之路还会继续精进,更微创的手术,更便捷的治疗方式,更安心的疾病监测,都会让「她」没什么不一样。
参考文献:
[1]HALSTED, W. S. (1894, July). THE RESULTS OF OPERATIONS FOR THE CURE OF CANCER OF THE BREAST PERFORMED AT THE JOHNS HOPKINS HOSPITAL FROM JUNE, 1889, TO JANUARY, 1894. Annals of Surgery. Ovid Technologies (Wolters Kluwer Health).
[2]National Institutes of Health Consensus Development Panel Consensus Statement. Treatment of early-stage breast cancer. J Natl Cancer Inst Monogr.1992; 11:11.
[3]Plesca M, Bordea C, El Houcheimi B, Ichim E, Blidaru A. Evolution of radical mastectomy for breast cancer. J Med Life. 2016 Apr-Jun;9(2):183-6.
[4]Fisher B, Jeong JH, Anderson S, Bryant J, Fisher ER, Wolmark N. Twenty-five-year follow-up of a randomized trial compar- ing radical mastectomy, total mastectomy, and total mastectomy followed by irradiation. N Engl J Med. 2002;347(8):567–75.
[5]Veronesi U, Cascinelli N, Mariani L, Greco M, Saccozzi R, Luini A, Aguilar M, Marubini E. Twenty-year follow-up of a randomized study comparing breast-conserving surgery with radical mastectomy for early breast cancer. N Engl J Med. 2002 Oct 17;347(16):1227-32.
[6]Fisher B, Anderson S, Bryant J, Margolese RG, Deutsch M, Fisher ER, Jeong JH, Wolmark N. Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer. N Engl J Med. 2002 Oct 17;347(16):1233-41.
[7]Yuan Q, Hou J, He Y, Liao Y, Zheng L, Wu G. Minimize the extent and morbidity of axillary dissection for node-positive breast cancer patients: implementation of axillary lymph node dissection based on breast lymphatics level. BMC Cancer. 2021 Mar 19;21(1):293.
[8]Kelley MC, Hansen N, McMasters KM. Lymphatic mapping and sentinel lymphadenectomy for breast cancer. Am J Surg. 2004 Jul;188(1):49-61.
[9]Giuliano AE, Ballman KV, et al. Effect of Axillary Dissection vs No Axillary Dissection on 10-Year Overall Survival Among Women With Invasive Breast Cancer and Sentinel Node Metastasis: The ACOSOG Z0011 (Alliance) Randomized Clinical Trial. JAMA. 2017 Sep 12;318(10):918-926.
[10]Swain SM, Miles D, Kim SB, et al.CLEOPATRA study group. Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA): end-of-study results from a double-blind, randomised, placebo-controlled, phase 3 study. Lancet Oncol. 2020 Apr;21(4):519-530.
[11]Gianni L, Pienkowski T, et al.Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncol. 2012 Jan;13(1):25-32.
[12]Shao Z, Pang D, Yang H, et al. Efficacy, Safety, and Tolerability of Pertuzumab, Trastuzumab, and Docetaxel for Patients With Early or Locally Advanced ERBB2-Positive Breast Cancer in Asia: The PEONY Phase 3 Randomized Clinical Trial. JAMA Oncol. 2020 Mar 1;6(3):e193692.
[13]Schneeweiss A, Chia S, et al. Long-term efficacy analysis of the randomised, phase II TRYPHAENA cardiac safety study: Evaluating pertuzumab and trastuzumab plus standard neoadjuvant anthracycline-containing and anthracycline-free chemotherapy regimens in patients with HER2-positive early breast cancer. Eur J Cancer. 2018 Jan;89:27-35.
[14]Dang C, Ewer MS, et al. BERENICE Final Analysis: Cardiac Safety Study of Neoadjuvant Pertuzumab, Trastuzumab, and Chemotherapy Followed by Adjuvant Pertuzumab and Trastuzumab in HER2-Positive Early Breast Cancer. Cancers (Basel). 2022 May 24;14(11):2596.
[15]Adjuvant Pertuzumab and Trastuzumab in Early HER2-Positive Breast Cancer. N Engl J Med. 2017 Aug 17;377(7):702.
[16]VP6-2022: Adjuvant pertuzumab and trastuzumab in patients with early HER-2 positive breast cancer in APHINITY: 8.4 years' follow-up.
[17]Ismael G, Hegg R, et al.Subcutaneous versus intravenous administration of (neo)adjuvant trastuzumab in patients with HER2-positive, clinical stage I-III breast cancer (HannaH study): a phase 3, open-label, multicentre, randomised trial. Lancet Oncol. 2012 Sep;13(9):869-78.
[18]Jackisch C, Stroyakovskiy D, Pivot X, Ahn JS, Melichar B, Chen SC, Meyenberg C, Al-Sakaff N, Heinzmann D, Hegg R. Subcutaneous vs Intravenous Trastuzumab for Patients With ERBB2-Positive Early Breast Cancer: Final Analysis of the HannaH Phase 3 Randomized Clinical Trial. JAMA Oncol. 2019 May 1;5(5):e190339.
[19]Pivot X, Gligorov J, Müller V, Barrett-Lee P, Verma S, Knoop A, Curigliano G, Semiglazov V, López-Vivanco G, Jenkins V, Scotto N, Osborne S, Fallowfield L; PrefHer Study Group. Preference for subcutaneous or intravenous administration of trastuzumab in patients with HER2-positive early breast cancer (PrefHer): an open-label randomised study. Lancet Oncol. 2013 Sep;14(10):962-70.
[20]Gligorov J, Ataseven B, Verrill M, De Laurentiis M, Jung KH, Azim HA, Al-Sakaff N, Lauer S, Shing M, Pivot X; SafeHer Study Group. Safety and tolerability of subcutaneous trastuzumab for the adjuvant treatment of human epidermal growth factor receptor 2-positive early breast cancer: SafeHer phase III study's primary analysis of 2573 patients. Eur J Cancer. 2017 Sep;82:237-246.
[21]NCCN. Clinical Practice Guidelines in Breast Cancer v4. 2023.
[22]Tan AR, Im SA, et al. FeDeriCa study group. Fixed-dose combination of pertuzumab and trastuzumab for subcutaneous injection plus chemotherapy in HER2-positive early breast cancer (FeDeriCa): a randomised, open-label, multicentre, non-inferiority, phase 3 study. Lancet Oncol. 2021 Jan;22(1):85-97.
[23]Shao Z,et al.ESMO Asia Congress 2022.1MO.
[24]O'Shaughnessy J, Sousa S, et al. Preference for the fixed-dose combination of pertuzumab and trastuzumab for subcutaneous injection in patients with HER2-positive early breast cancer (PHranceSCa): A randomised, open-label phase II study. Eur J Cancer. 2021 Jul;152:223-232.
[25]Gonzalez-Santiago S, et al. 2023 ESMO BC Abstract 116P
[26]Jackisch C, Manevy F, Frank S, Roberts N, Shafrin J. White Paper on the Value of Time Savings for Patients and Healthcare Providers of Breast Cancer Therapy: The Fixed-Dose Combination of Pertuzumab and Trastuzumab for Subcutaneous Injection as an Example. Adv Ther. 2022 Feb;39(2):833-844.
[27]NCCN. Clinical Practice Guidelines in Breast Cancer v4. 2023.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


