Cancer Cell:卢煜明院士团队发表重磅综述——cfDNA片段组学开启癌症无创诊断新纪元
来源:转化医学网 2025-10-08 11:23
该内容系统阐述了通过分析血液中cfDNA的断裂模式来早期发现癌症的最新科学突破,为液体活检技术开辟了全新方向。
近日,一项由香港中文大学卢煜明院士团队发表在《Cancer Cell》的综述揭示了细胞游离DNA(cfDNA)片段组学在癌症检测中的革命性潜力。该内容系统阐述了通过分析血液中cfDNA的断裂模式来早期发现癌症的最新科学突破,为液体活检技术开辟了全新方向。

从基因测序到碎片密码:癌症检测的范式转变
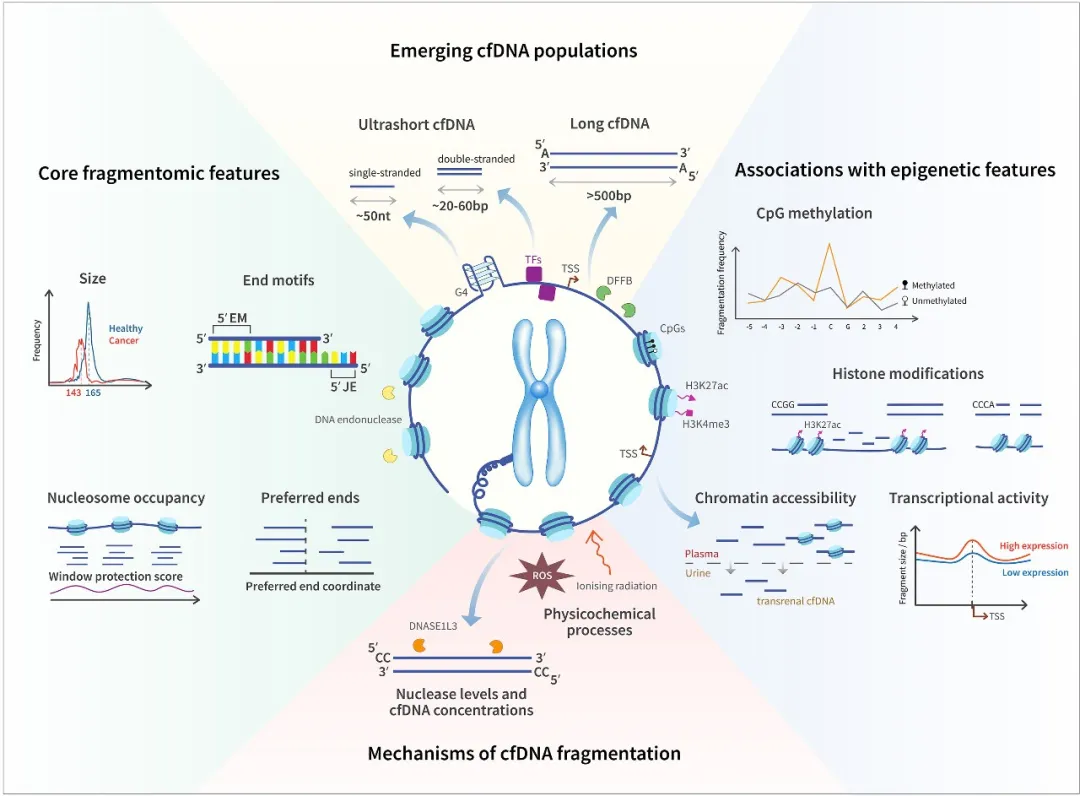
DNA片段化模式被认为与潜在的遗传和表观遗传景观密切相关,cfDNA的生成、释放和清除过程中涉及特定的片段化机制
传统癌症液体活检主要依赖于检测循环肿瘤DNA(ctDNA)中的基因突变或甲基化变化。然而,这种基于遗传变异的方法面临两大挑战:早期肿瘤的突变频率极低,以及不同患者间肿瘤遗传异质性高。就像在海量数据中寻找特定单词,而这个单词可能只出现几次甚至一次。cfDNA片段组学则另辟蹊径——通过分析这些DNA碎片的大小、末端序列、核小体占位等物理特征,揭示肿瘤细胞特有的死亡和释放模式。研究发现,肿瘤来源的cfDNA往往呈现更短的片段长度(约143bp)、独特的末端基序(如富含CC的5'端),以及异常的核小体保护区域,这些特征与肿瘤的染色质结构、转录活性及细胞死亡方式密切相关。
技术革新:从基础发现到临床应用
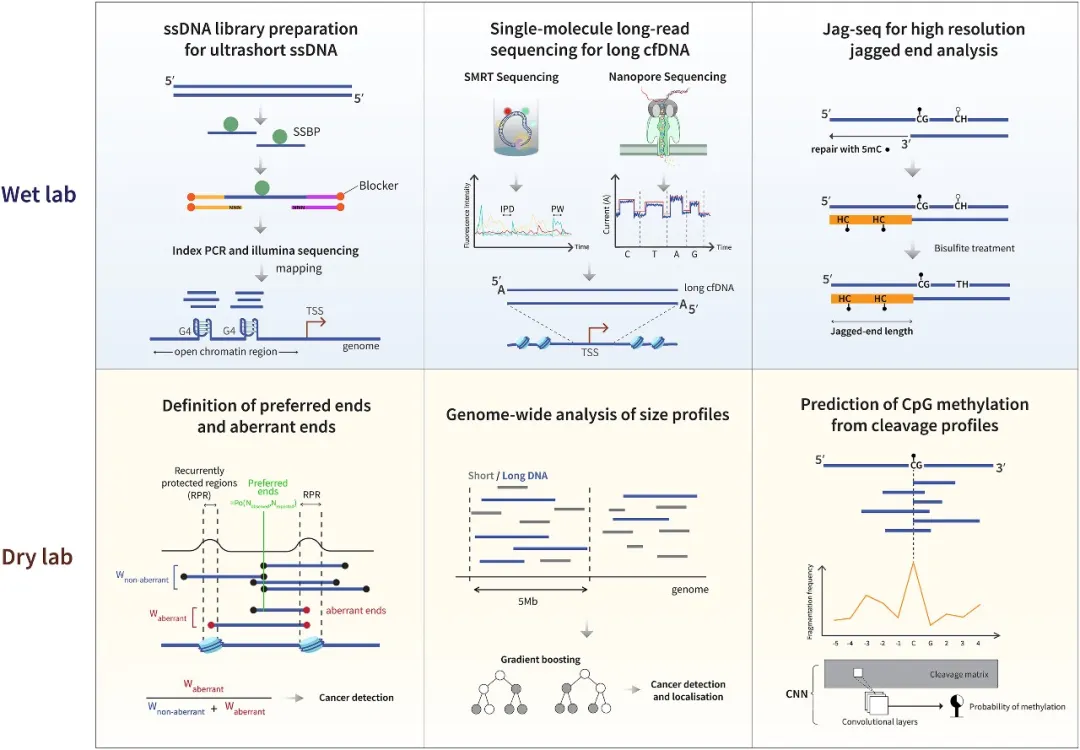
湿实验与干实验技术创新实例,这些技术助力癌症中片段组学特征的发现、表征与应用
研究内容详细梳理了推动该领域发展的三大技术突破:
1.长读长测序技术
第三代测序平台首次捕捉到超过500bp的长片段cfDNA,这些分子携带更多遗传信息,可帮助追溯组织来源。研究发现肝癌患者的肿瘤相关长片段cfDNA在活跃转录基因区域显著富集。
2.超短片段发现
通过改良的单链DNA文库制备技术,科学家发现了约50bp的极短片段。这类片段富含启动子区域信号,在尿液中尤为显著,为开发泌尿系统肿瘤无创检测提供了新靶标。
3.人工智能赋能
最新开发的深度学习模型(如iLLMAC、EMIT)能解析数十亿级DNA末端序列的复杂模式。中山大学团队构建的Transformer模型通过分析4-mer末端基序排列,对肺癌的检测准确率达96.2%。
这相当于教会计算机阅读DNA断裂的语言,就像破译摩斯密码,每个片段特征都是肿瘤留下的独特信号。
临床验证:从实验室到病床的关键一步
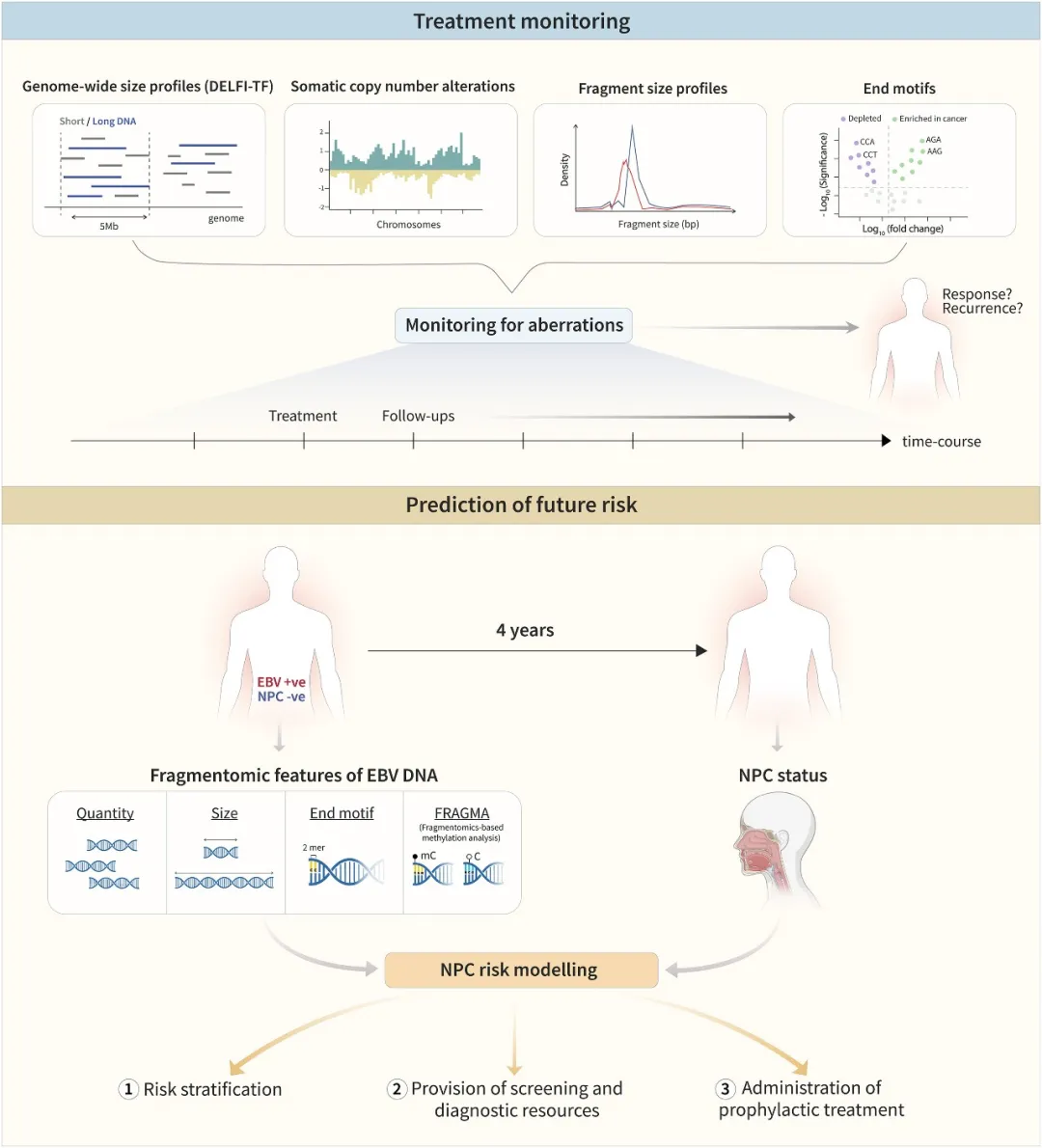
cfDNA片段组学在治疗监测与风险预测中的新兴应用
多项临床试验正在验证该技术的实际价值:
DELFI-Lung试验(美国23个中心):对958名受试者的分析显示,该技术对肺癌的整体敏感性达84%,对I期患者也保持78%的检出率。
SPOT-MAS多癌种筛查(越南):在2795名健康体检者中,成功识别出6例肿瘤患者,其中4例通过后续检查确认。
PreCar肝癌研究(中国):在肝硬化人群中实现93.8%的检测灵敏度,对早期肝癌(BCLC 0/A期)检出率达66.7%。
特别值得注意的是,结合EB病毒DNA片段组学特征,香港团队将鼻咽癌风险预测的相对危险度提升至87.1倍,为高危人群筛查策略优化提供了依据。
未来展望:机遇与挑战并存
尽管该技术前景广阔,研究者指出仍需解决多个关键问题:
生物学机制:不同细胞死亡方式(如凋亡vs坏死)产生的片段特征差异尚未完全阐明。
技术标准化:文库制备试剂和测序平台的差异可能导致结果偏差,亟需建立统一质控标准。
人群特异性:GWAS研究发现欧洲人群中DNASE1L3基因变异的影响在亚洲人群可能不同。
当前我们正站在精准医学的新起点,通过整合片段组学、表观遗传学和人工智能,未来有望实现真正的一滴血测癌,不仅早期发现肿瘤,还能预测治疗反应和复发风险。这项工作系统性地整合了十年来的关键技术突破,为cfDNA片段组学的临床转化绘制了清晰的路线图。特别是人工智能算法的应用,标志着癌症检测进入模式识别新阶段。据悉,基于该技术的商业化检测产品已进入FDA审批快车道,预计未来3-5年内将在部分癌种筛查中实现临床应用。
原文链接:
https://www.cell.com/cancer-cell/fulltext/S1535-6108(25)00398-8
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


