Cell:重大进展!科学家构建 3D 子宫内膜模型,首次全程还原人类胚胎植入全过程
来源:生物谷原创 2026-01-05 10:14
该研究的成功,不仅填补了人类胚胎早期发育研究的空白,更为生殖医学带来了革命性工具,有望让 “生命黑箱” 变得透明。
胚胎植入是妊娠的起点,却也是最神秘的 “生命黑箱”—— 受精后约一周,胚胎会嵌入子宫内膜,这一阶段失败是早期妊娠丢失和试管婴儿(IVF)成功率低的主要原因。
如今,Babraham 研究所与斯坦福大学的研究团队在《Cell》发表重磅成果:他们成功构建了能高度模拟人类子宫内膜的 3D 模型(CREST),首次在体外完整还原了胚胎植入及后续 14 天的发育过程,为破解植入失败、妊娠并发症的起源提供了全新工具。

“理解胚胎植入和早期发育具有至关重要的临床意义,因为这些阶段的失败率极高,尤其成为 IVF 成功的主要瓶颈。” 领导该研究的 Babraham 研究所高级课题组负责人 Peter Rugg-Gunn 博士强调。长期以来,由于胚胎植入后会隐藏在子宫内,科学家无法直接观察这一过程,相关研究只能依赖静态的组织切片或动物模型,而人与其他物种的植入机制差异巨大,导致很多关键问题悬而未决。
为打破这一僵局,研究团队打造了一套 “复刻版” 子宫内膜。他们从健康捐赠者的子宫内膜活检组织中,分离出上皮细胞和基质细胞这两种核心细胞类型——前者构成子宫内膜的表面屏障,后者是深层支撑组织。为还原子宫内膜的复杂结构,团队通过转录组数据分析,筛选出胶原蛋白 I、III、VI 和纤连蛋白等关键胞外基质成分,将其与基质细胞一起封装进含金属蛋白酶切割位点的葡聚糖水凝胶中,这种水凝胶能在胚胎植入时被降解,模拟体内的组织微环境。随后,他们将上皮细胞培养成类器官片段,接种在水凝胶表面,最终形成厚度约 180 微米、结构与真实子宫内膜高度一致的 3D 模型。
更关键的是,这个人工子宫内膜具备真实的生理响应能力。在雌激素、孕激素和环磷酸腺苷(cAMP)的依次刺激下,基质细胞会从细长形态变为立方形,分泌催乳素(PRL)和胰岛素样生长因子结合蛋白 1(IGFBP1),完成妊娠前的 “蜕膜化” 准备;上皮细胞则会形成连续的单层结构,表面出现植入窗口特有的 “胞饮突”,还会发育出分支管状的腺体样结构,分泌 “子宫乳” 所需的糖蛋白(如 PAEP),为胚胎提供营养——这些特征完全复刻了体内子宫内膜迎接胚胎的 “准备过程”。
为验证模型的有效性,研究团队使用了 IVF 程序中捐赠的人类早期胚胎。结果令人振奋:胚胎在模型中完整经历了从孵化、粘附到侵入的全过程——受精后 5-6 天,胚胎从透明带中孵化并扩张;7 天左右,胚胎的滋养外胚层朝向子宫内膜表面,开始松散接触(定位);8 天左右,胚胎紧密粘附并使囊胚腔塌陷,标志着植入成功;10 天左右,胚胎穿透上皮层,完全嵌入子宫内膜模型。最终,60% 的移植胚胎成功完成植入,这一效率与体内自然植入水平相当。
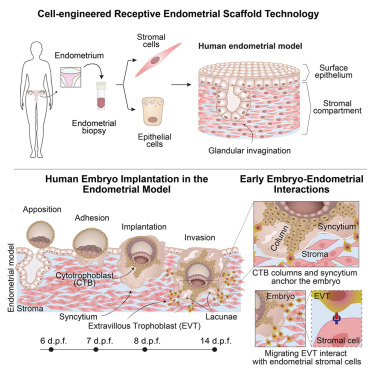
植入后的胚胎并未停止发育。研究人员观察到,胚胎会持续分泌人绒毛膜促性腺激素(hCG)——这种妊娠标志物的分泌规律与体内一致,且随着滋养层细胞的发育逐渐升高。更重要的是,模型支持胚胎发育至受精后 14 天,这是以往体外培养难以实现的突破。
在这一阶段,胚胎形成了双胚层结构、羊膜腔和卵黄囊,滋养层细胞进一步分化为细胞滋养层、合体滋养层和侵袭性的绒毛外滋养层,甚至出现了胎盘发育的早期结构——滋养层细胞柱和细胞滋养层壳,这些都是体内胚胎发育的关键里程碑。
通过单细胞 RNA 测序,研究团队还 “窃听” 了胚胎与子宫内膜的分子通讯。他们识别出 84 对关键的配体-受体相互作用,例如绒毛外滋养层细胞分泌的 PROS1 与子宫内膜基质细胞表达的 AXL 受体结合,这种信号通路对滋养层细胞的侵袭和胚胎着床至关重要。当使用 AXL 抑制剂 R428 阻断这一通路时,胚胎的滋养层细胞生长明显受阻,证实了这些分子互作的功能性作用。值得注意的是,这些信号通路中,部分在妊娠后期的母胎界面依然活跃,暗示植入阶段的通讯异常可能埋下子痫前期、胎儿生长受限等并发症的隐患。
“胚胎植入和植入后发育是隐藏的关键事件,这限制了我们探索背后细胞和分子机制的能力。现在,我们可以见证生命最初时刻未被探索的方面,揭示健康妊娠的建立基础。” 研究共同第一作者、博士后研究员 Irene Zorzan 博士表示。除了还原正常发育过程,该模型还具有广阔的临床应用前景——未来可构建患者特异性模型,分析不育人群的子宫内膜是否存在植入相关的功能缺陷,或测试能提升子宫内膜容受性的药物;对于 IVF 患者而言,这一模型有望帮助筛选最具植入潜力的胚胎,提高妊娠成功率。
“胚胎与子宫内膜的同步通讯是母婴健康的关键。我们的模型首次让这种通讯过程变得可见、可干预,这对理解不育症、降低妊娠并发症风险具有里程碑意义。” 研究共同第一作者、高级研究科学家 Sarah Elderkin 博士总结道。该研究的成功,不仅填补了人类胚胎早期发育研究的空白,更为生殖医学带来了革命性工具,有望让 “生命黑箱” 变得透明。(生物谷Bioon.com)
参考文献:
Matteo A. Molè et al, Modelling human embryo implantation in vitro, Cell (2025). DOI: 10.1016/j.cell.2025.10.027.
版权声明
本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->





