Theranostics:STK39通过磷酸化增加SNAI1活性促进乳腺癌侵袭转移
来源:本站原创 2021-06-25 16:26
Snai1被广泛认为是上皮-间充质转化(EMT)的主要驱动力,与乳腺癌的进展和转移有关。这种致癌作用与翻译后修饰密切相关,特别是磷酸化,它控制其蛋白水平和亚细胞定位。虽然多种激酶参与了SNAI1稳定性的调节,但SNAI1在肿瘤中稳定的确切机制仍未完全阐明。作者的研究表明,STK39是SNAI1稳定性的关键介质,并与促进转移的细胞过程有关,强调STK39-SN
Snai1被广泛认为是上皮-间充质转化(EMT)的主要驱动力,与乳腺癌的进展和转移有关。这种致癌作用与翻译后修饰密切相关,特别是磷酸化,它控制其蛋白水平和亚细胞定位。虽然多种激酶参与了SNAI1稳定性的调节,但SNAI1在肿瘤中稳定的确切机制仍未完全阐明。作者的研究表明,STK39是SNAI1稳定性的关键介质,并与促进转移的细胞过程有关,强调STK39-SNAI1信号轴是治疗转移性乳腺癌的有前途的治疗靶点。
图片来源:https://www.thno.org/v11p7658.pdf
大约90%的癌症死亡是由转移引起的。转移过程经历了四个不同的阶段:侵袭、内渗、外渗和转移定植。侵袭能力的发展源于肿瘤细胞顶端-基底极性的丧失和细胞间黏附。这些特征让人想起EMT期间发生的事件,EMT被认为是肿瘤转移过程中的关键一步。广泛的研究表明,与转移相关的子宫内膜癌是由一个复杂的转录因子网络控制的,这些转录因子包括SNAI1/slug家族、twist、δEF1/ZEB1和SIP1/ZEB2。因此,更好地理解这些因子如何在分子水平上调节肿瘤转移是至关重要的。
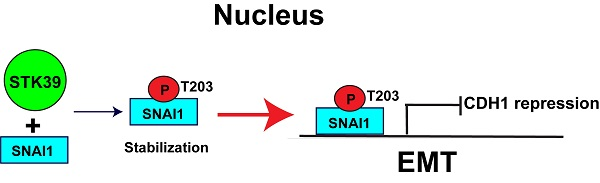
Snai1是一种含锌指转录因子,在发育或肿瘤进展过程中通过直接抑制E-cadherin(CDH1)的转录来诱导EMT。作者和其他人的研究表明,SNAI1的表达与肿瘤分级相关,并预示着不良的患者预后。SNAI1诱导细胞凋亡抵抗,导致肿瘤复发,产生乳腺癌干细胞(CSC)样特性,诱导有氧糖酵解。有趣的是,SNAI1在转录和蛋白质水平上都受到严格控制。许多生长因子和细胞因子可以转录调控SNAI1的表达。此外,SNAI1是一种易受影响的蛋白质,被泛素-蛋白酶体途径降解,尽管有结构性的mRNA表达。目前,一些含有F-box的泛素连接酶通过激酶依赖的磷酸化信号级联参与SNAI1降解的调节。例如,gsk3β磷酸化SNAI1并诱导核输出,从而促进β-trcp介导的泛素化依赖的降解。同时,其他激酶通过诱导核输入、核滞留或阻止其泛素化降解来增强SNAI1的稳定性。这些不同类型的磷酸化控制着SNAI1介导的EMT的灵活性和可逆性。
尽管激酶的数量与SNAI1的稳定性有关,但仍需要对SNAI1磷酸化和降解的分子机制有更深入的了解。在本研究中,作者评估了STK39在SNAI1稳定性中的作用。作为STE20样激酶家族的成员,STK39具有可能的核定位信号和caspase裂解位点。全长STK39在非刺激条件下呈弥漫性定位,而caspase裂解的STK39位于细胞核内。STK39因其在多种生理过程中的作用而被研究,包括调节氯和水的运输,细胞转化和增殖,以及细胞分化。值得注意的是,STK39通过磷酸化介导的激活来调节这些生理过程。在人类癌症中,STK39的表达升高,并与非小细胞型肺癌和骨肉瘤的不良肿瘤分期和不良预后呈正相关。STK39还参与调节多种癌症的肿瘤细胞增殖、迁移和侵袭,包括骨肉瘤和宫颈癌。然而,激活STK39促肿瘤作用的分子机制在很大程度上仍不清楚。
STK39通过磷酸化增加SNAI1活性促进乳腺癌侵袭转移
图片来源:https://www.thno.org/v11p7658.pdf
在这里,作者证明了STK39与SNAI1相互作用,并通过增加其核保留来促进SNAI1的稳定性。作者的结果还表明,内源性STK39的缺失会导致SNAI1的降解、EMT的抑制和转移,这表明STK39在EMT的诱导中是必不可少的。此外,STK39的缺失会影响肿瘤细胞对化疗药物的敏感性。总体而言,作者的数据揭示了EMT中STK39-SNAI1轴的新机制,并进一步强调STK39是乳腺癌治疗的一个有前途的治疗靶点。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



