Frontiers in Cell and Developmental Biology:发现高原低氧适应基因RETSAT抑制皮肤黑色素瘤进展的新分子机制
来源:昆明动物所 2021-12-31 08:17
中国科学院昆明动物研究所陈勇彬课题组和施鹏课题组以RETSAT Mutation Selected for Hypoxia Adaptation Inhibits Tumor Growth为题,在Frontiers in Cell and Developmental Biology上在线发表了研究论文。陈勇彬课题组采用遗传进化与肿瘤学交叉学科的研
中国科学院昆明动物研究所陈勇彬课题组和施鹏课题组以RETSAT Mutation Selected for Hypoxia Adaptation Inhibits Tumor Growth为题,在Frontiers in Cell and Developmental Biology上在线发表了研究论文。
陈勇彬课题组采用遗传进化与肿瘤学交叉学科的研究方法,筛选高原哺乳动物低氧适应的关键新基因,解析其在低氧实体瘤中的功能与分子机制,研究成果分别发表在Nature Communications(2019)、National Science Review(2019)、Cell Research(2021)、Signal transduction and targeted therapy(2021a/2021b)、Theranostics(2020)和Cancer Letters(2020)等上。
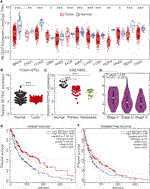
陈勇彬课题组前期与施鹏课题组、中科院动物研究所詹祥江课题组合作,运用整合组学的分析方法,发现不同的野生哺乳动物利用相同的遗传进化分子机制实现高原适应。研究发现,视黄醇饱和酶(Retinol Saturase,RETSAT)的一个氨基酸位点在高原适应的野生哺乳动物中均发生了谷氨酰胺(Q)到精氨酸(R)的突变。科研人员利用Knock-In(KI)点突变小鼠体内功能实验证实,高原突变(R)基因修饰小鼠相比野生型小鼠,主动脉直径变大,心脏功能变强,多个内脏器官血氧饱和度变大,在极限低氧饲养条件下的存活时间也更长(相关成果发表在Cell Research上)。进一步研究发现,RETSAT启动子区域高甲基化,导致其在多种低氧实体瘤中低表达且与不良预后显着相关。而敲低或过表达RETSAT,促进或抑制皮肤黑色素瘤细胞的增殖能力。体内功能研究表明,相对于野生型小鼠,RETSAT高原突变(R)基因修饰小鼠在DMBA/TPA诱导下形成SCC的能力下降,且小鼠黑色素瘤细胞系B16移植瘤形成能力下降。分子机制研究显示,RETSAT突变促进视黄酸代谢途径,下调原癌基因Pin1的表达,并抑制其下游Akt信号通路的活性和肿瘤的进程。 (生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


