Science | 突破血脑屏障:新型AAV载体为大脑疾病基因治疗带来新选择
来源:生物探索 2024-05-22 11:32
该研究设计了一种AAV衣壳,BI-hTFR1,它能结合人类转铁蛋白受体(TfR1),这种蛋白在血脑屏障(BBB)上表达。
博德研究所Bejamine Deverman团队(黄琴、Ken Y. Chan为第一作者)在Science 在线发表题为“An AAV capsid reprogrammed to bind human transferrin receptor mediates brain-wide gene delivery”的研究论文,该研究设计了一种AAV衣壳,BI-hTFR1,它能结合人类转铁蛋白受体(TfR1),这种蛋白在血脑屏障(BBB)上表达。与AAV9相比,BI-hTFR1在穿过人脑内皮细胞层时具有更高的主动运输能力,并且在携带人类TFRC基因敲入的小鼠CNS中提供了40-50倍的报告基因表达增强。这种增强的趋向性是CNS特异性的,在野生型小鼠中并不存在。
当用于递送GBA1基因时,该基因的突变会导致戈谢病并与帕金森病有关,BI-hTFR1显著增加了大脑和脑脊液中的葡萄糖脑苷脂酶活性,相比于AAV9。这些发现确立了BI-hTFR1作为人类CNS基因治疗的有前途的载体。
在开发更高效的基因治疗递送载体时,一个关键挑战是设计出具有已知作用机制(MOA)且与人类患者相关的载体。传统上,为了增强腺相关病毒(AAV)的趋向性,研究人员主要依赖于在动物体内进行的衣壳库筛选。在过去的二十年中,许多研究小组使用这种方法,因为它可以在不需要预先了解MOA的情况下取得成功。然而,在动物中筛选出的载体大多无法在临床前模型中获得相同的效果。尽管进行了广泛的搜索,但尚未描述出具有明确转化潜力和已知MOA的AAV衣壳,以用于进入CNS。
在此,作者从不同的角度出发,首先为特定的MOA(即与人类转铁蛋白受体(TfR1)结合)选择AAV衣壳,并展示了其中一个衣壳可以穿过血脑屏障(BBB),并在整个CNS中进行有效的基因递送。作者选择TfR1作为目标,因为它在人的BBB上高表达,能够介导构成性、配体非依赖性的受体介导的跨细胞运输(RMT)通过CNS血管,并且在增加小鼠、非人灵长类动物(NHP)和人类CNS生物制剂递送中的记录良好。
作者首先筛选了7-肽修饰的AAV9衣壳库,以其在体外结合人类TfR1的能力。表现最好的衣壳AAV-BI-hTFR1显示出对人脑内皮细胞更有效的基因递送,并改善了其通过人类血管单层的主动运输。当系统性地注射到携带嵌合Tfrc基因且其胞外域人源化的TFRC敲入(KI)小鼠时,BI-hTFR1转导了多个脑区的大部分神经元和星形胶质细胞。这种增强的趋向性完全依赖于与人源化TfR1的相互作用,因为在野生型(WT)小鼠中我们没有观察到增强效应。这种趋向性在CNS中选择性增强,与TFRC在CNS血管中的高表达水平一致。
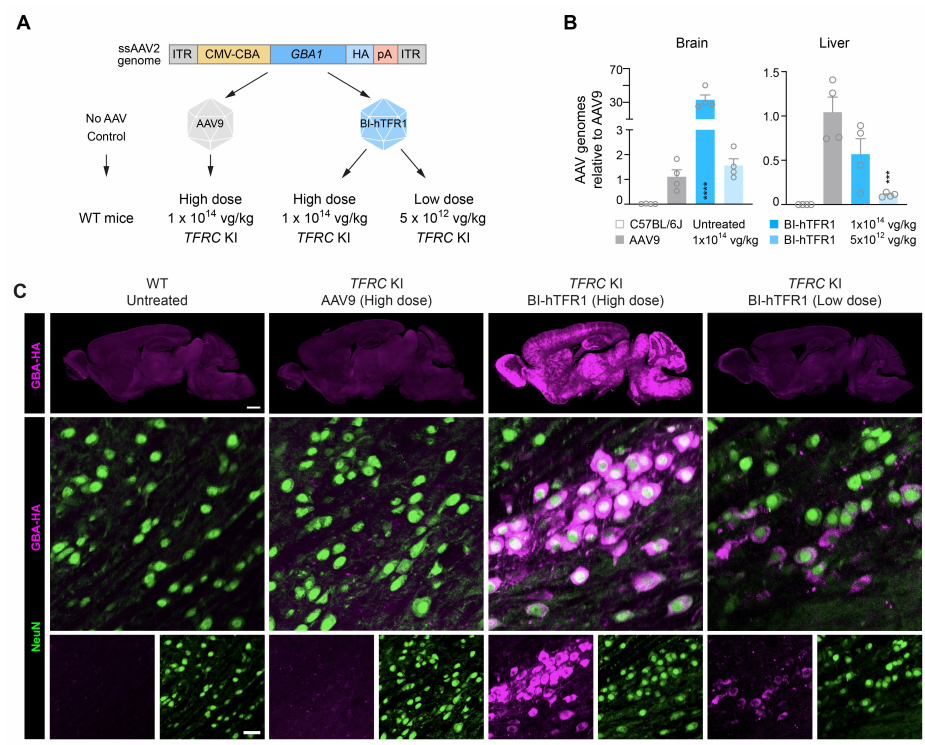
BI-hTFR1有效递送GBA1并增加TFRC KI小鼠大脑中GCase活性(Credit: Science)
为了探索其递送治疗性相关货物的能力,作者将携带人葡糖脑苷脂酶1(GBA1)基因的BI-hTFR1或AAV9静脉注射到TFRC KI小鼠中。GBA1的失活突变是戈谢病的主要原因,这是一种通常影响CNS的溶酶体贮积症,并且GBA1突变是帕金森病和路易体痴呆的遗传风险因素。在成年TFRC KI小鼠中系统性递送BI-hTFR1:GBA1后,整个大脑的表达增加,并且脑和脑脊液(CSF)中的葡糖脑苷脂酶(GCase)活性升高,这在使用AAV9时未观察到。通过直接与TfR1(人类天然蛋白配体及治疗性生物制剂的受体)结合,BI-hTFR1代表了开发针对CNS的人类基因治疗的有前途的载体。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


