《科学》子刊:科学家发现Tau蛋白诱发阿尔茨海默病等疾病神经炎症的新机制!
来源:奇点糕 2023-02-03 13:13
神经退行性疾病的发生伴随神经炎症激活。有研究者认为,神经炎症可能直接参与诱导疾病的发生,因此探究诱导神经炎症的因素对神经退行性疾病早期筛查和防治有重要意义。
神经退行性疾病的发生伴随神经炎症激活。有研究者认为,神经炎症可能直接参与诱导疾病的发生,因此探究诱导神经炎症的因素对神经退行性疾病早期筛查和防治有重要意义。
此前有研究表明,致病形式的Tau蛋白能够激活反转录转座子,并且发现反转录转座子能够在人类疾病发生过程中驱动炎症[1]。然而,Tau蛋白诱导的转座子激活是否促进神经炎症尚属未知。
近日,由圣安东尼奥德克萨斯大学健康科学中心Elizabeth Ochoa领衔的研究团队在《科学进展》杂志发表最新研究成果。研究发现致病性Tau蛋白能够通过促进反转录转座子衍生的双链RNA(dsRNA)形成来驱动神经退化和神经炎症[2]。
他们在阿尔茨海默病(AD)患者、进行性核上性麻痹(PSP)患者和Tau转基因小鼠脑组织均发现了星形胶质细胞中dsRNA及其识别蛋白含量升高。这项研究首次表明反转录转座子激活介导的dsRNA水平升高可能是AD和PSP等原发性Tau病(tauopathy)的特征。

论文首页截图
反转录转座子是进化上广泛存在的遗传元件,它通过RNA拷贝的逆转录进行复制,并将产物DNA整合到宿主基因组的新位点。反转录转座子在人类基因组中的占比达到35%。除了诱导突变,反转录转座子的不良作用还可能来自于反转录转座子RNA、编码蛋白、衍生dsRNA、互补DNA等。
Tau蛋白是一种微管相关蛋白,它在人大脑中异常沉积会导致“Tau病”,常见的Tau病包括AD和PSP等神经退行性疾病。近期多项研究表明,逆转录转座子在tau蛋白介导的神经毒性中被激活是导致神经退行性病变的原因[3]。
此前,Elizabeth Ochoa团队发现在AD患者大脑中反转录转座子含量升高。另外,反转录转座子在其他疾病中已经证实能够形成dsRNA。那么,反转录转座子衍生的dsRNA是否在Tau病个体中升高呢?
研究人员收集不同病理阶段AD患者PSP患者脑组织样本,利用J2抗体标记dsRNA,结果发现,与对照组相比,Tau病组织样本中dsRNA含量显著升高。利用胶质纤维酸性蛋白(GFAP)和微管相关蛋白2(MAP2)抗体分别标记星形胶质细胞和神经元,与抗体J2共染,结果发现dsRNA仅在星形胶质细胞中显著富集。
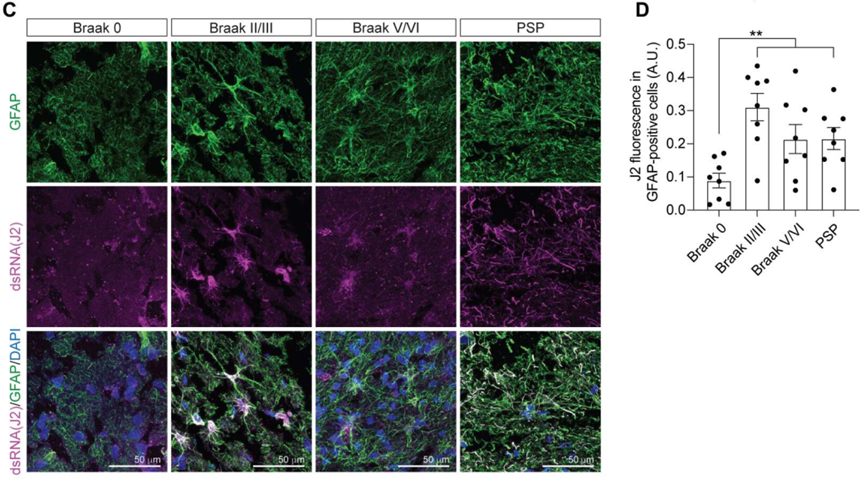
dsRNA在星形胶质细胞中显著富集
作为一种病原相关分子模式,dsRNA能够诱导干扰素反应。黑素瘤分化相关蛋白5(MDA5)是一种dsRNA解旋酶,属于维甲酸诱导基因I样(RIG-I)受体家族。RIG-I受体是非常重要的模式识别受体,它能够通过识别相关分子模式激活先天性免疫反应。MDA5能够通过识别长dsRNA以完成抗病毒天然免疫反应。研究人员将MDA5和GFAP进行共染,结果发现MDA5在Tau病脑组织的星形胶质细胞中表达显著升高。这说明在Tau病脑组织中dsRNA监视系统被激活。
dsRNA监视系统在Tau病脑组织的星形胶质细胞中显著升高
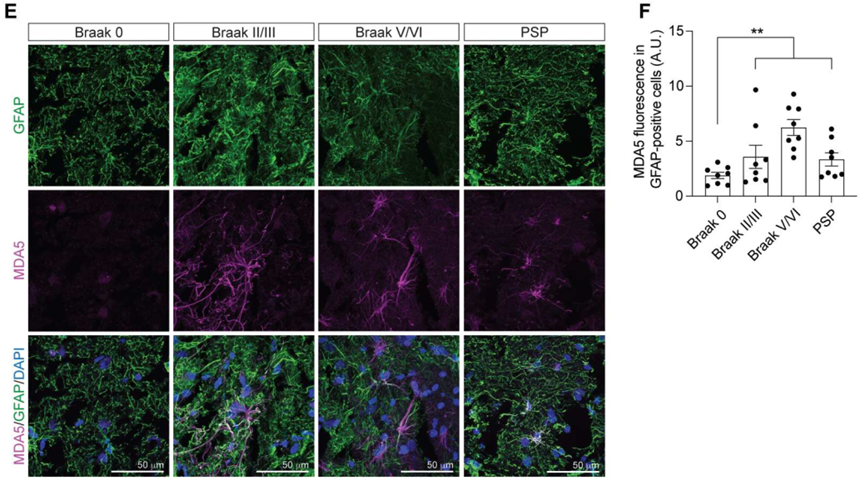
接下来,研究者观察dsRNA在Tau转基因小鼠脑组织中的累积是否改变。本研究使用的转基因小鼠为rTg4510,此小鼠能在Camk2a启动子控制下过表达与疾病相关的人源Tau蛋白突变形式。许多人类Tau病症状在rTg4510小鼠模型中复现,包括胶质增生、神经元缺失和转座子激活等。J2免疫荧光染色的结果表明,与对照组相比,J2蛋白在rTg4510小鼠的前额皮质组织中表达显著升高。
此外,与人类的研究结果相似,J2蛋白在rTg4510小鼠的星形胶质细胞中表达升高。也就是说,dsRNA在Tau致病蛋白过表达的小鼠模型中形成增多。MDA5和GFAP共染实验结果发现,MDA5在rTg4510小鼠的星形胶质细胞中表达升高。
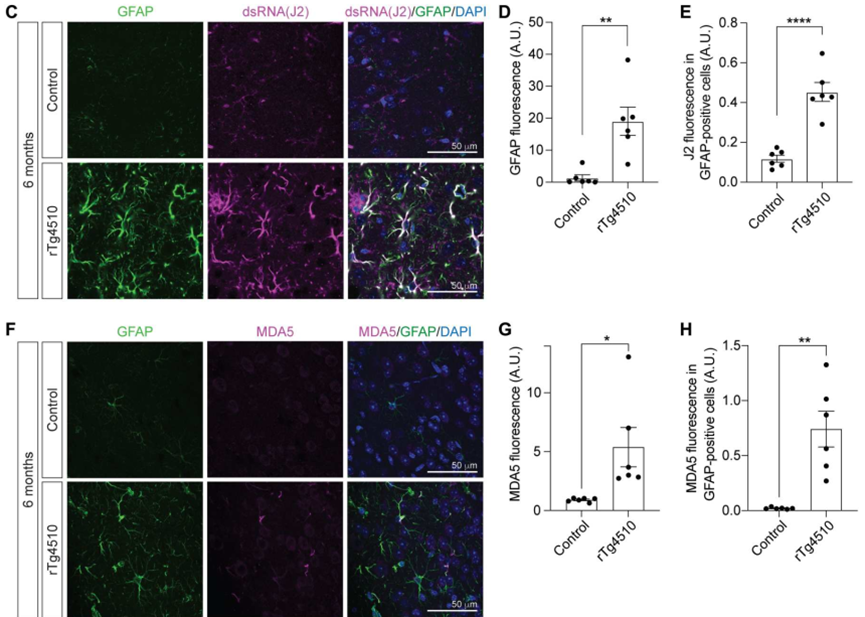
dsRNA和dsRNA识别蛋白在rTg4510小鼠星形胶质细胞中表达升高
在本研究中,Elizabeth Ochoa团队利用Tau转基因果蝇探究了Tau蛋白、反转录转座子、dsRNA和神经退化之间的机制联系,通过检测J2和K2蛋白的表达量来评估果蝇头部dsRNA水平。结果表明,dsRNA在转基因果蝇头部含量显著升高。另外,J2免疫荧光染色显示Tau转基因果蝇的脑组织中dsRNA含量显著增加。
前文已经提到,dsRNA识别蛋白在Tau蛋白异常沉积的人和小鼠脑组织中表达增多。那么,促进dsRNA识别和清除是否能改善dsRNA在Tau转基因果蝇中的累积及其导致的神经毒性呢?
Dicer-2是核糖核酸酶III家族的dsRNA特异性内切酶,负责果蝇模型中dsRNA的识别和清除。研究者在泛神经元过表达Dicer-2发现,Dicer-2过表达能够显著降低dsRNA水平。此外,过表达Dicer-2能够有效减少Tau转基因果蝇的神经退行性病变。以上结果表明Tau蛋白诱导的dsRNA增加确实介导了神经毒性产生。
此前研究者发现,在果蝇泛神经元中过表达人源Tau蛋白能够从两方面干扰转座子控制:一是异染色质介导的反转录转座子转录沉默,二是piRNA介导的反转录转座子RNA转录后降解。针对这两方面的基因挽救实验发现,降低反转录转座子转录水平的同时能够抑制Tau蛋白诱导的神经毒性。研究人员敲低异染色质调控基因发现,异染色质解凝能够增加果蝇脑组织中dsRNA水平。
基于dsRNA与先天性免疫的机制联系,研究者推测dsRNA形成可能是驱动神经炎症的因素。利用NanoString免疫反应相关探针检测发现突变人Tau蛋白在泛神经元的表达能够促进Toll、IMD和Jak/Stat通路上先天免疫基因的转录。此外,异染色质解凝也能够显著升高Toll、IMD和Jak/Stat通路上先天免疫基因转录本的表达。
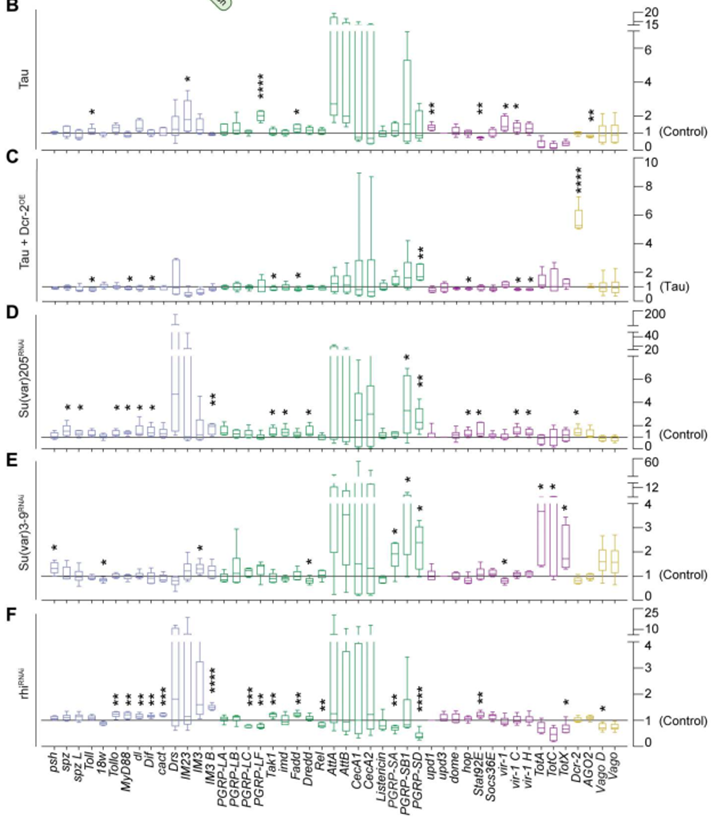
致病性Tau和异染色质解凝诱导神经炎症
总的来说,本研究通过调查多种Tau病模型中dsRNA升高的程度,以及dsRNA产生的来源和机制以及随后的神经炎症,将致病性tau诱导的逆转录转座子激活与dsRNA形成联系了起来。
参考文献:
[1] Gorbunova V, Seluanov A, Mita P, et al. The role of retrotransposable elements in ageing and age-associated diseases. Nature. 2021;596(7870):43-53. doi:10.1038/s41586-021-03542-y
[2] Ochoa E, Ramirez P, Gonzalez E, et al. Pathogenic tau-induced transposable element-derived dsRNA drives neuroinflammation. Sci Adv. 2023;9(1):eabq5423. doi:10.1126/sciadv.abq5423
[3] Guo C, Jeong HH, Hsieh YC, et al. Tau Activates Transposable Elements in Alzheimer's Disease. Cell Rep. 2018;23(10):2874-2880. doi:10.1016/j.celrep.2018.05.004
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


