中国CLDN18.2首个II期数据亮相,能否做成best in class?
来源:医药魔方 2023-06-08 14:03
2022年以来,康诺亚/乐普生物、石药集团、科伦博泰等多家公司陆续实现将Claudin18.2(CLDN18.2)项目授权给海外药企。风生水起的出海浪潮背后,一方面是国内众多药企看好该靶点,采取了单抗
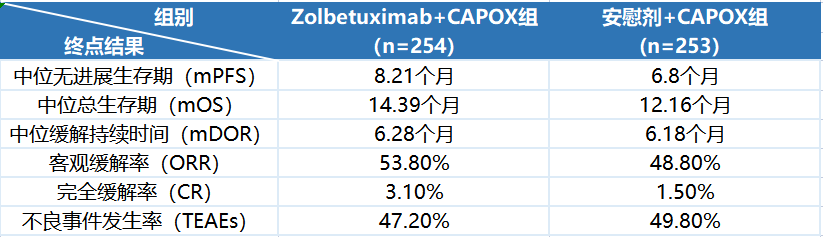
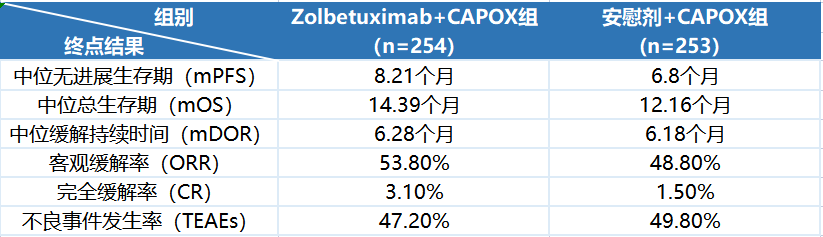
2022年以来,康诺亚/乐普生物、石药集团、科伦博泰等多家公司陆续实现将Claudin18.2(CLDN18.2)项目授权给海外药企。风生水起的出海浪潮背后,一方面是国内众多药企看好该靶点,采取了单抗、双抗、ADC、CAR-T等不同多技术路线的“饱和式攻击”,从而富集了全球最多的CLDN18.2资产;另一方面则是安斯泰来Zolbetuximab的III期研究成功,大大增加了CLDN18.2成药前景的确定性。不过身处CLDN18.2靶点的白热化竞争之下,如何填补临床未满足需求、实现差异化是入局药企们需要高度关注的命题。
更大的患者群体:Osemitamab对
CLDN18.2低表达肿瘤同样有效
CLDN18.2蛋白是Claudin(紧密连接蛋白)家族中的一员,该蛋白家族通过在细胞旁建立屏障,来控制细胞间分子的流动。正常情况下,CLDN18.2蛋白主要在胃黏膜分化的上皮细胞表面表达。但在胃癌、胰腺癌、胆管癌在内的多种癌症中,CLDN18.2蛋白却被异常高表达。数据显示,CLDN18.2蛋白在胃癌患者中的表达率为40%~80%[1-2],在胰腺癌患者中的表达率为50%~70%[3]。
此外,CLDN18.2在正常组织中通常埋藏在紧密连接的超分子复合物中,很难被大分子抗体药物触及到。然而在恶性肿瘤发生时,紧密连接蛋白会遭到破坏,肿瘤细胞的CLDN18.2表位随之暴露出来,从而可与靶向CLDN18.2药物发生特异性结合以达到治疗目的。CLDN18.2靶点的火热就在于其对亚洲人群高发癌种,尤其是胃癌的治疗潜力。
创胜集团在ASCO 2023大会上公布了Osemitamab(TST001)+CAPOX方案一线治疗不可切除局部晚期或转移性G/GEJ腺癌的I/II期研究(TranStar102/TST001-1002)队列C的疗效和安全性数据,该研究纳入的患者均为CLDN18.2阳性表达(≥10%肿瘤细胞的CLDN18.2膜染色强度≥1+)。截至2023年4月21日,共有64例患者完成入组并接受了治疗,其中包括15例患者在剂量递增阶段分别接受Osemitamab(TST001)1mg/kg(n=3)、3mg/kg(n=3)、6mg/kg(n=3)或8mg/kg(n=6)Q3W+CAPOX治疗、剂量扩展阶段49例患者接受Osemitamab(TST001)6mg/kg Q3W+CAPOX治疗。
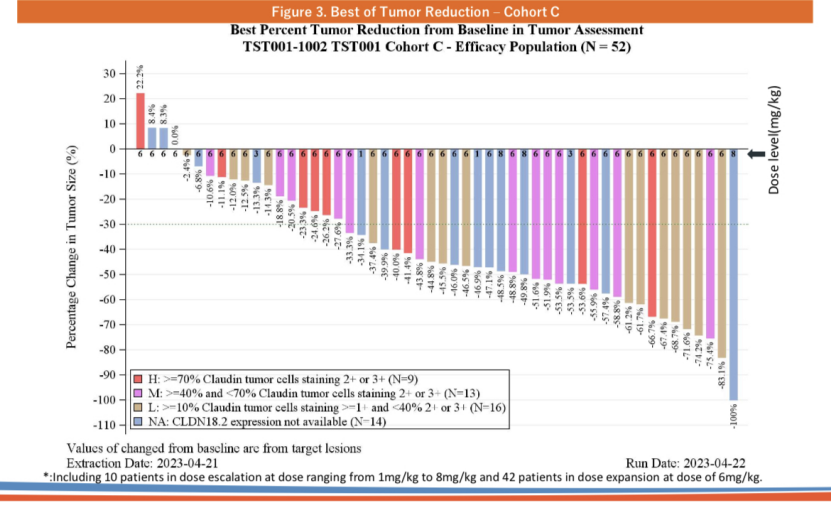
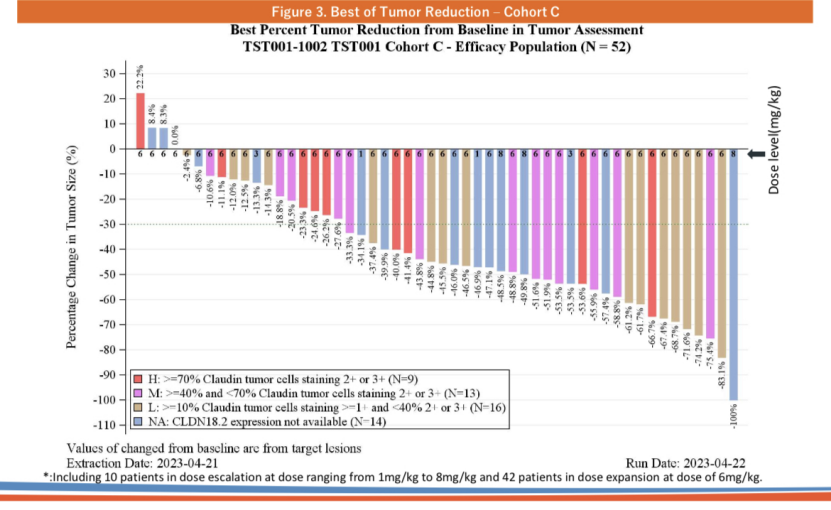
C队列患者疗效数据(来源:创胜官网)
数据显示,剂量扩展组的49名患者中有42名患者具有可测量病灶并接受至少一次治疗后肿瘤评估。根据RECIST 1.1标准,28例患者(66.7%)获得部分缓解(PR)。所有剂量组中34名反应者的预计中位缓解持续时间(mDOR)为9.9个月,预计中位无进展生存期(mPFS)为9.5个月。
Osemitamab(TST001)与Zolbetuximab在临床开发策略上的最大区别是放宽了入组患者的CLDN18.2表达水平,并不要求CLDN18.2高表达。这也是因为Zolbetuximab在针对G/GEJ腺癌患者的II期FAST研究中未能显著改善CLDN18.2中等表达患者人群的PFS和OS,因此安斯泰来在III期研究中设置了CLDN18.2表达水平需要≥75%的入组“门槛”。但是有统计数据显示,CLDN18.2表达水平>70%的胃癌患者仅占全部患者35%~40%,也就是说,Zolbetuximab即便成功上市,由于当前III期研究中入组人群的局限性,能够带来获益的患者群体也就有限,这也给后来者的开发策略和市场竞争留下了空间。
Osemitamab(TST001)正是捕捉到了这一机会并初步取得了成功。结果显示,Osemitamab(TST001)+CAPOX化疗不仅在CLDN18.2高表达(表达水平≥70%)患者中显示出了治疗效果,其在CLDN18.2中表达(40%≤表达水平<70%)、低表达(10%≤表达水平<40%)患者中均显示出了出色的治疗效果。69.2%(9/13)的CLDN18.2中表达患者、68.8%(11/16)的CLDN18.2低表达患者实现了PR;除此之外,71.4%(10/14)的CLDN18.2未知表达患者也实现了PR。
此外,Osemitamab(TST001)+CAPOX化疗也表现出了良好的耐受性。所有64例入组患者都接受了安全性和耐受性评估。治疗中出现的不良事件大多为1~2级,包括贫血、低白蛋白血症、恶心、呕吐、血小板计数降低。仅有一名患者在6mg/kg剂量组出现了3级恶心和呕吐,一名患者在8mg/kg剂量组出现了3级低白蛋白血症。没有4级不良事件发生。
更广泛的应用场景:Osemitamab展现
best in class潜力
对于先行者Zolbetuximab留下的改进空间,CLDN18.2赛道玩家的差异化策略各有不同,包括伴随技术迭代的双抗、ADC、CAR-T产品也相继出现。不过从适应症开发的角度来看,绝大多数CLDN18.2“后来者”还是保守求稳地选择了从后线治疗开始做起。
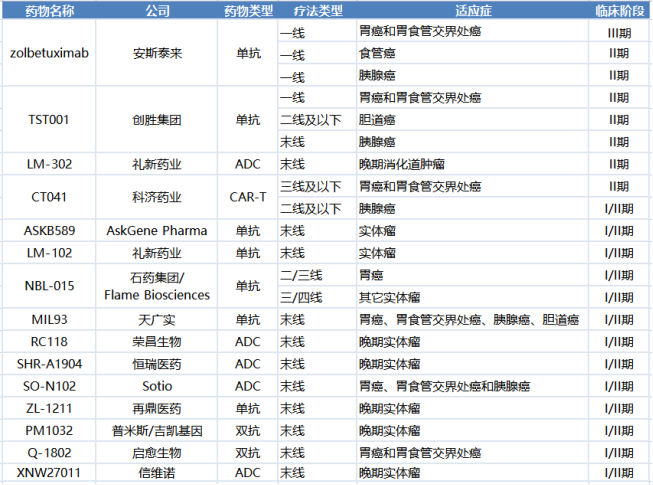
已进入I/II期临床的CLDN18.2在研项目
与之相反,创胜集团则多了点冒险精神,一开始就选择让Osemitamab(TST001)在适应症上对标Zolbetuximab,同样是角逐G/GEJ腺癌的一线疗法。这种自信其实要建立在对自家分子的绝对信心之上。Osemitamab(TST001)是基于创胜集团独有的免疫耐受屏障突破(IMTB)技术平台开发,工艺技术上是对Osemitamab(TST001)的Fc端进行了去除核心岩藻糖(Fucose)的修饰,进而增强抗体与NK细胞表面激活型受体FcγRIIIa的结合能力,从而显著增强了Osemitamab(TST001)的ADCC(抗体依赖性细胞毒性)杀伤效应。
本次ASCO大会上创胜集团公布的Osemitamab(TST001)+CAPOX化疗在CLDN18.2高、中至低表达G/GEJ腺癌患者中均显示出了抗肿瘤活性也是对Osemitamab(TST001)分子结构设计策略最直接的证明。也正是基于Osemitamab(TST001)+CAPOX良好的疗效及安全性数据,创胜集团表示将于今年下半年启动Osemitamab(TST001)治疗晚期G/GEJ腺癌患者的全球多中心III期临床。如果Osemitamab(TST001)能在更大规模的III期研究中取得成功,作为一线疗法并且不受CLDN18.2表达水平的限制,无疑是会给更广大的胃癌患者带来获益。这也就让Osemitamab(TST001)具备了best in class的潜力。
当前胃癌的临床治疗也已进入免疫治疗时代。2021年4月,FDA基于CheckMate-649研究批准了Opdivo联合化疗一线治疗晚期或转移性胃癌、胃食管结合部腺癌和食管腺癌患者(无论患者的PD-L1表达情况如何)。 Opdivo+化疗是FDA批准的第一款一线治疗胃癌的免疫疗法。不过此疗法也存在着一定的改进空间,近期相关研究分析也表明PD-L1低表达(CPS<5)胃癌患者群体未能从Opdivo+化疗治疗中得到显著获益 [4] 。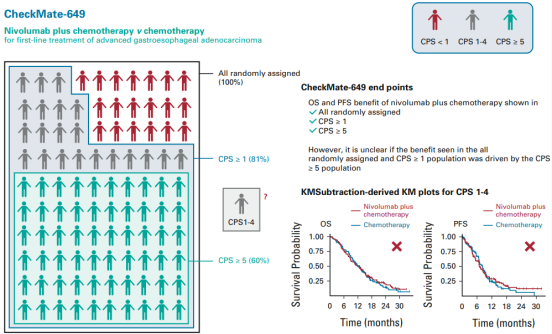
一项在中国患者中开展的研究显示,超过80%的CLDN18.2阳性(≥10%肿瘤细胞的CLDN18.2膜染色强度≥1+)患者的PD-L1处于低表达水平(CPS<5)。这意味着这部分患者(包括胃癌患者)对Opdivo+化疗组合的响应可能不佳。正是处于对PD-L1低表达胃癌患者群体的考虑,创胜集团开展了Osemitamab(TST001)+Opdivo+化疗 vs Opdivo+化疗一线治疗胃癌的临床研究,有望为那些无法从PD-(L)1疗法中受益的患者提供新的治疗选择。
随着CLDN18.2靶点临床实力的逐渐凸显,越来越多的相关药物将会进入临床阶段。为了筛选得到更精准的获益人群、开发CLDN18.2伴随诊断试剂也是相关药企必须关注的重点。正是基于此,创胜集团还同步开发了面向全球临床开发的CLDN18.2伴随诊断检测试剂盒(CDx),为启动Osemitamab(TST001)的全球多中心III期临床做好了充足的准备。伴随诊断的开发已逐渐成为FDA和EMA重要的审批标准,创胜集团前瞻性地布局伴随诊断也将对其管线中包括Osemitamab(TST001)在内的创新药出海奠定坚实的基础。
结语
全球在研CLDN18.2项目已超120款,这让CLDN18.2成为最内卷的靶点之一。从FIC产品Zolbetuximab的现有数据来看,其疗效还不能覆盖CLDN18.2中、低表达G/GEJ腺癌患者,在CLDN18.2高表达G/GEJ腺癌患者中的PFS和OS获益也均未超过3个月,这也意味着CLDN18.2靶点的临床价值还有继续升级优化的空间。
Osemitamab(TST001)从开始选择的就是冲击胃癌一线疗法,其全球三期临床预计在Zolbetuximab批准前即能启动,“后来者”要想抢占一线胃癌市场,可能需要头对头挑战Zolbetuximab+化疗组合,需入组人数和开发成本也会大幅增加,开发风险也会增加。创胜集团开发的Osemitamab(TST001)基于当前优异的I/II期数据和系统化布局,已与其它选手的拉开了一定的差距,初步显示了成为BIC的潜力。也期待国内围绕CLDN18.2靶点的双抗、ADC、CAR-T等产品公布更多的临床数据,届时哪款产品将凭实力脱颖而出,成为真正的BIC,我们拭目以待。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


