BJH:科学家有望利用iPS细胞技术揭示人类髓系肿瘤发生背后的分子机制
来源:生物谷原创 2024-09-14 14:21
本文研究结果阐明了iPSC模型在解释由染色体结构改变所引起的增强子劫持中的精确分子机制,同时还发现了用于癌症治疗的潜在治疗性候选药物分子。
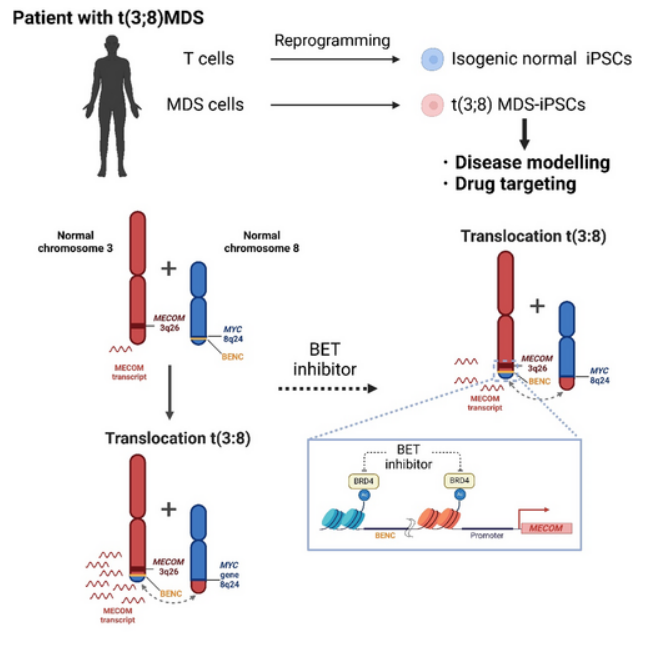
涉及增强子劫持的结构突变会诱导异常癌基因表达并导致肿瘤发生。近日,一篇发表在国际杂志British Journal of Haematology上题为“Modelling and drug targeting of a myeloid neoplasm with atypical 3q26/MECOM rearrangement using patient-specific iPSCs”的研究报告中,来自日本京都大学等机构的科学家们通过研究利用由MECOM和MYC基因之间的罕见染色体重排所引起的髓系肿瘤(myeloid neoplasm)患者机体所产生的iPS细胞成功建立了一种特殊的癌症模型,从而就能更深入地理解髓系肿瘤的致病机制并测试潜在的药物疗法。

引起癌症的原因很多,但癌症发生的一个主要原因就是染色体的重排,其能促使促癌基因从其它基因中劫持增强子元件从而增加其异常表达;比如,3号染色体上的反复重排(inv(3)(q21.3q26.2) or t(3;3)(q21.3;q26.2))就能将GATA2增强子放置在MECOM (EVI1)启动子附近,并通过异常增强MECOM的基因表达来驱动血液恶性肿瘤的发生。研究者表示,一种称之为骨髓增生异常综合征(MDS)/急性髓性白血病(AML)的白血病就具有非典型的3q26重排,其包括t(3;8)(q26.2;q24),其中染色体的改变会导致MECOM的异常高表达。
尽管这些染色体重排非常少见,但由此所产生的癌症的预后也相对较差,患者的中位生存期仅有6个月,因此,WHO于2022年将其指定为具有MECOM重排的新型AML类别。为了深入了解这种新分类的疾病并识别出潜在的治疗性策略,研究人员成功从携带t(3;8)(q26.2;q24)的MDS患者机体中建立了iPS细胞(MDS-iPSCs),其或能展现出与最初从患者身上收集的细胞相同的染色体异常现象。具体而言,染色体断裂点位于3q26.2上的MECOM(MDS1-EVI1 and EVI1)启动子的上游区域和8q24上MYC超级增强子的上游区域,研究人员随后将这些MDS-iPSCs分化为造血祖细胞(MDS-HPCs),并将其作为研究MDS疾病的疾病模型。
科学家有望利用iPS细胞技术揭示人类髓系肿瘤发生背后的分子机制
图片来源:British Journal of Haematology (2024). DOI:10.1111/bjh.19720
正如预期的那样,MDS-HPCs能表现出白血病的形态并展现出了向髓系(粒细胞和单核细胞)和红系(红细胞)谱系细胞分化的缺陷。研究者表示,通过RNA测序进行基因表达分析或能揭示很多功能异常的基因,其中对于造血分化非常重要的多种因子的表达都会下降,相反,相比等基因正常iPS细胞所产生的HPCs而言,MDS-HPCs中对于维持HSC非常重要的很多调节子的表达都会被增强。值得注意的是,MDS-HPCs能表现出AML样的基因表达特征,此外,MECOM基因表达也会在MDS-HPCs中显著增加,这就与该疾病的假设因果作用一致了。
表观遗传学分析结果表明,MDS1-EVI1和EVI1启动子的活性在MDS-HPCs中会显著增加,这就与因MYC超级增强子易位导致患者机体HPCs中的MECOM表达增强相一致。BRD4是溴结构域和外链(BET)蛋白家族的一员,其会在超级增强子中积累,于是研究人员推测,抑制BRD4的功能或许能抑制致癌基因的表达,为了验证这一假设,研究人员利用BRD4抑制剂JQ1对MDS-HPCs进行处理,并监测MECOM的表达情况。尽管JQ1疗法并不会影响对照HPCs,但却会显著降低MDS-HPCs中的MECOM表达,与此相一致的是,基于荧光报告的分析结果表明,JQ1能有效降低来自EVI1位点中的基因表达。
然而,重要的是,JQ1疗法也会以一种剂量依赖性的方式导致MDS-HPCs中细胞死亡的增加,但却并不会影响对照HPCs,这或许就显示出了抵御MDS/AML的强大治疗潜力。本文研究结果再次证明了iPS细胞技术在模拟人类疾病中的巨大潜力,并增强了其或能作为一种有效的手段测试有前途的疗法疗效,而且这些疗法也能在诊所中用作治疗措施。
综上,本文研究结果阐明了iPSC模型在解释由染色体结构改变所引起的增强子劫持中的精确分子机制,同时还发现了用于癌症治疗的潜在治疗性候选药物分子。(生物谷Bioon.com)
参考文献:
Momoko Nakamura, Kazuhisa Chonabayashi, Megumi Narita, et al. Modelling and drug targeting of a myeloid neoplasm with atypical 3q26/MECOM rearrangement using patient‐specific iPSCs, British Journal of Haematology (2024). DOI:10.1111/bjh.19720
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


