《胃肠病学》:迄今最大规模多组学分析,揭示胃癌致命腹膜转移的玄机!
来源:奇点糕 2024-09-11 09:53
本研究完成了迄今规模最大的胃癌腹膜转移基因组、转录组学和肿瘤微环境特征分析。
许多癌症在转移时都有独特的“招牌动作”,比如肺癌脑转移、肠癌肝转移、乳腺癌骨转移等等,但要说哪种转移让奇点糕最难忘,那非胃癌的腹膜转移莫属:与平时提及的癌症远处转移不同,胃癌细胞往往被认为是直接“种植”到了腹膜,而腹膜转移患者极差的预后(中位生存期3-6个月,5年生存率约2%[1])和极大的治疗难度,更是足以让人谈之色变。
虽说胃癌腹膜转移如此致命,但科学家和临床工作者对它的了解还显得太少太少,得到的答案远远不如谜题多,精准施治和破局自然就无从谈起。为了填补这么多的知识空白,新加坡多所顶级研究机构的研究者们就在近日合作,完成了迄今规模最大的胃癌腹膜转移基因组、转录组学和肿瘤微环境特征分析,研究结果发表在《胃肠病学》(Gastroenterology)期刊上[2]。
研究通过多组学分析揭示,病情尚在早期的胃癌患者腹膜即存在“转移前微环境”(pre-metastatic niche),符合癌症转移经典的种子-土壤理论,而存在ELF3、CDH1、PIGR等基因突变和微环境特定改变的胃癌原发灶更易导致腹膜转移;此外,通过对腹膜转移灶及周边组织的直接取样分析,研究也找到了腹膜转移的多组学特征和潜在治疗靶点。
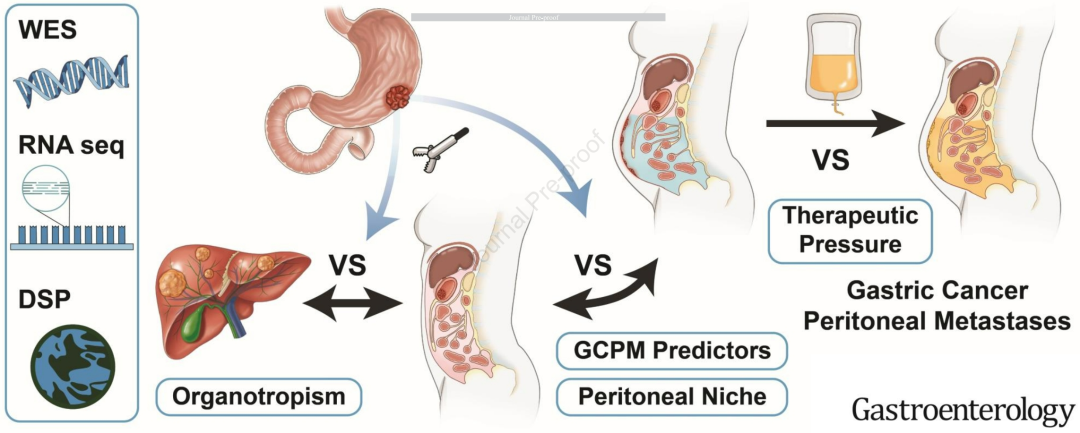
一图总结研究主要提供的有价值信息
本次研究包括前瞻队列和横断面队列两部分,前者分析了277例原发性患者的355份样本,而后者则纳入55例胃癌腹膜转移患者的196份样本,专门用于验证分析前瞻性队列得到的初步猜想,且研究纳入患者超过85%是华人,对我国胃癌诊治的参考价值极高;在腹膜转移的发生时间上,56例转移为同时性(发生在确诊胃癌6个月内),61例为异时性。
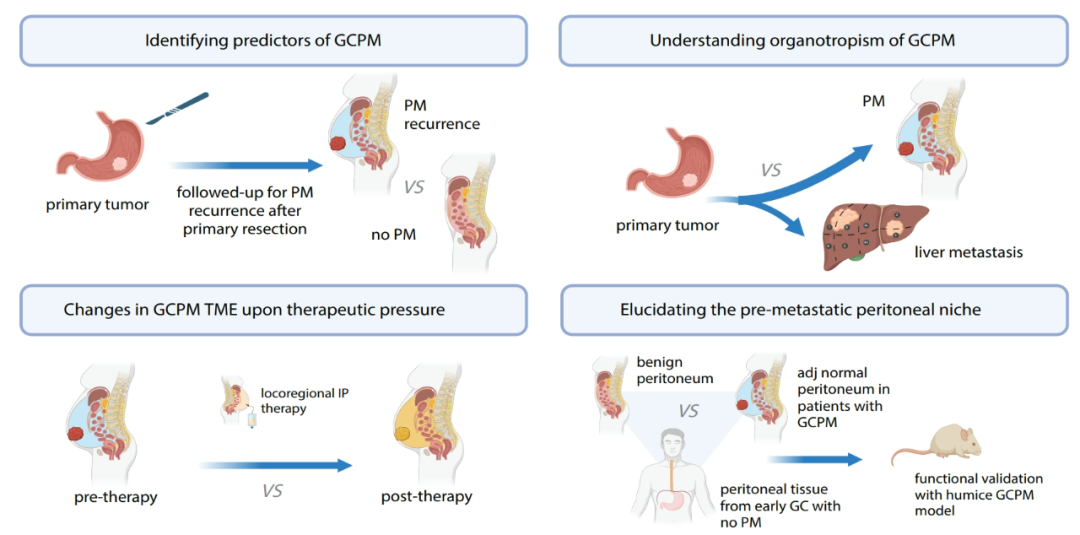
研究流程简要介绍
经过对前瞻性队列患者中位时间长达87个月的随访,共有56例患者发生腹膜转移,生存预后显著不良,而肿瘤体积较大、分期较晚(T分期/N分期)、亚型属TCGA分型的基因组稳定型(GS)[3]或间充质亚型[4],以及肿瘤微环境整体属于纤维化或免疫富集/纤维化亚型[5],原发肿瘤存在ELF3、CDH1、PIGR等基因突变,均与腹膜转移风险显著升高有关。

可能提示腹膜转移高危的临床/基因/组学特征
基因集富集分析(GSEA)还揭示,间质浸润能力强、发生上皮-间质转化(EMT)和IL2-STAT5、干扰素-γ等炎症通路显著富集的肿瘤,也有较高的腹膜转移可能性;而肿瘤中有较多的肿瘤相关成纤维细胞(CAFs)、内皮细胞、记忆B细胞、M2型巨噬细胞,以及原发肿瘤间质内有较多的NK细胞、浆细胞、调节性T细胞、肥大细胞和巨噬细胞也是不利因素。
接下来,研究者们开始分析腹膜转移与胃癌向其它部位远处转移的差异,以此找到驱动腹膜转移的推手:转录组学、基因通路和细胞术分析显示,EMT和间质浸润能力强化,以及髓系髓样树突状细胞和特定CAFs亚群(iCAFs/myCAFs)的富集,都是腹膜转移的独有特征,且与胃癌肝转移相比,腹膜转移灶的胃癌细胞更为间充质样,微环境纤维化也更明显。
而在聚焦治疗靶点的基因组学分析中,研究结果可以说“喜忧参半”:近年来热度较高的胃癌新靶点,例如CLDN18.2和FGFR2b,在腹膜转移中的表达水平均显著低于原发肿瘤,但腹膜转移也存在NTRK2/3、PIK3CA、TEAD1/2、DKK1、FGFR1、HPSE等基因,以及免疫检查点分子TIM-3的显著高表达(其它免疫检查点并无高表达),可能成为治疗“突破口”。
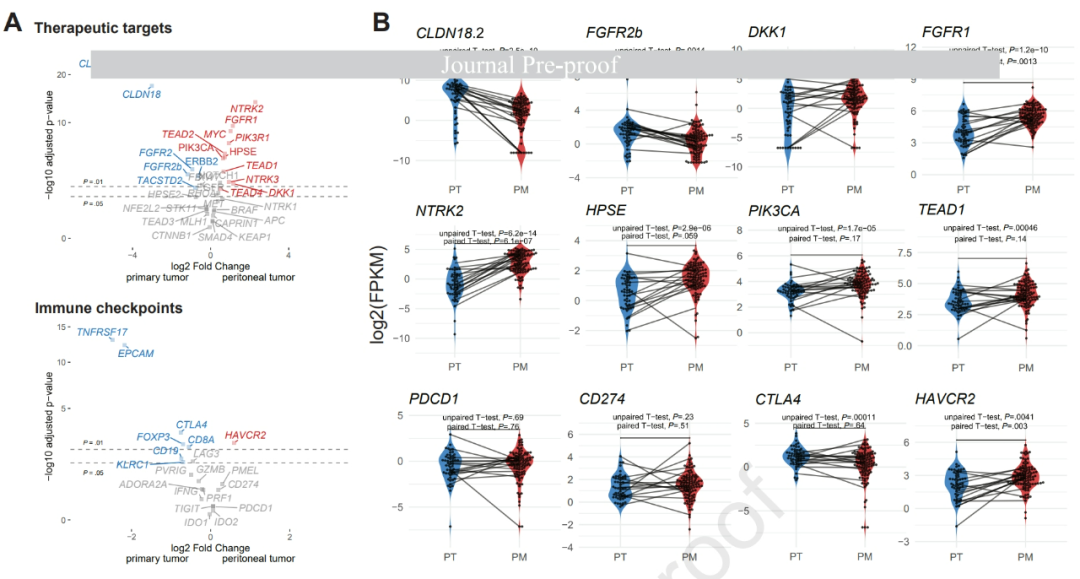
腹膜转移与原发肿瘤在潜在治疗靶点基因/主要免疫检查点分子表达方面的差异
针对腹膜转移治疗的“老大难”问题,研究者们还评估了接受系统性药物治疗和腹腔内局部化疗前后,腹膜转移的转录组学特点变化,发现在全身免疫治疗+腹腔内化疗后,腹膜转移灶的免疫浸润状态和炎症通路富集发生了明显改善,意味着二者存在协同增效性。
最后,借助对病程不同阶段患者样本的分析,研究者们证实早期胃癌患者的腹膜微环境也已发生了改变,存在利于癌细胞定植的转移前微环境,且能找到EMT等关键基因通路改变和髓样树突状细胞、CAFs等可能对转移有关键作用的细胞亚群,有望提早预测腹膜转移风险。
总而言之,本次研究成果标志着学界对胃癌腹膜转移的认识又往前推进了一大步,且研究者们还在人源化小鼠身上高度一致地复现了各项主要发现,这就意味着后续实验的平台都搭好了,既然万事俱备,后续研究冲就完了~
参考文献:
[1]Thomassen I, van Gestel Y R, van Ramshorst B, et al. Peritoneal carcinomatosis of gastric origin: a population‐based study on incidence, survival and risk factors[J]. International Journal of Cancer, 2014, 134(3): 622-628.
[2]Zhao J J, Ong C A J, Srivatsava S, et al. Spatially resolved niche and tumor microenvironmental alterations in gastric cancer peritoneal metastases[J]. Gastroenterology, 2024.
[3]Oh S C, Sohn B H, Cheong J H, et al. Clinical and genomic landscape of gastric cancer with a mesenchymal phenotype[J]. Nature Communications, 2018, 9: 1777.
[4]Cancer Genome Atlas Research Network. Comprehensive molecular characterization of gastric adenocarcinoma[J]. Nature, 2014, 513(7517): 202-209.
[5]Bagaev A, Kotlov N, Nomie K, et al. Conserved pan-cancer microenvironment subtypes predict response to immunotherapy[J]. Cancer Cell, 2021, 39(6): 845-865. e7.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


