Nature子刊:浙江大学钱鹏旭团队揭示造血干细胞可用于骨髓靶向白血病药物递送
来源:转化医学网 2024-07-24 10:54
【导读】白血病是一种源自骨髓的血液恶性肿瘤,为白血病的发生、发展和复发,提供了必要的信号。然而,如何特异性地将药物输送到骨髓,仍是一个难题。团队通过向造血干细胞和祖细胞 (HSPC) 膜注入脂质体(H

【导读】白血病是一种源自骨髓的血液恶性肿瘤,为白血病的发生、发展和复发,提供了必要的信号。然而,如何特异性地将药物输送到骨髓,仍是一个难题。团队通过向造血干细胞和祖细胞 (HSPC) 膜注入脂质体(HSPC 脂质体),来开发仿生囊泡。本研究提供了一种靶向骨髓和治疗白血病的方法。
2024年7月7日, 浙江大学医学院钱鹏旭团队在期刊《Nature Communications》上发表了题为“Hematopoietic stem and progenitor cell membrane-coated vesicles for bone marrow-targeted leukaemia drug delivery”的研究论文。本研究构建了靶向骨髓的HSPC仿生囊泡,为白血病的治疗提供了途径,为其他骨髓源性疾病的靶向治疗提供了参考。

https://www.nature.com/articles/s41467-024-50021-9#Sec2
研究背景
01
白血病是一种侵袭性造血恶性肿瘤,预后不良,死亡率高,对人们的健康构成严重威胁。在AmL(急性髓系白血病)中,化疗仍然是一线治疗,包括经典的化疗“3+7”方案(7天阿糖胞苷和3天蒽环类或蒽二酮)和最近报道的DAV(多柔比星、阿糖胞苷和维奈托克)方案,但这些治疗在某些患者中,仍然失败。此外,化疗不能完全清除残留的癌细胞,并有严重的副作用。在化疗达到缓解的窗口期进行造血干细胞移植(HSCT),是治疗白血病的重要策略。然而,造血干细胞移植,通常会遇到人类白细胞抗原 (HLA) 匹配困难和移植抗宿主病 (GVHD) 的挑战,并且通常面临移植后复发的风险。近年来,免疫检查点抑制剂、嵌合抗原受体T细胞(CAR-T)等免疫疗法,在B细胞源性恶性肿瘤的治疗中,显示出巨大的前景,但近一半的患者对免疫治疗仍无反应,甚至在治疗后复发。因此,在白血病治疗中,需要探索更好的治疗策略。
纳米颗粒在抗肿瘤药物的靶向递送方面,具有很大的优势,特别是在治疗白血病方面。脂质体药物递送系统,广泛应用于疫苗开发和癌症治疗,但未修饰的脂质体靶向能力较差,由于内循环时间短,容易被快速代谢清除。近年来,细胞膜包被的仿生纳米颗粒,在靶向递送至特定组织或器官方面,显示出良好的前景。细胞膜包被的纳米颗粒,由于其自身的组织特异性抗原或受体,而表现出良好的归巢能力,并具有免疫原性较低、内循环时间较长等优点。最近的研究表明,脂质体与间充质干细胞(或神经干细胞)膜的结合制备工程仿生囊泡,可以显著提高疾病的靶向能力和治疗效果。
在发病机制上,白血病起源于骨髓中造血干细胞的突变和恶性克隆扩增。因此,骨髓是白血病细胞产生和积累的关键部位。根据白血病发生的“两次命中”理论,白血病前期细胞的基因组,经历了两次命中。第一次命中,造成基因组不稳定性;第二次命中,引入致癌基因突变,转化为白血病干细胞。白血病细胞首先积聚在骨髓中,随后损害正常造血,最终浸润到血液循环中,并侵入其他器官。此外,药物治疗后,骨髓中残留的白血病干细胞,也是复发的重要因素。目前的化疗药物,不能在骨髓中充分积累;因此,靶向递送药物到骨髓,是治疗白血病的一种有前途的策略。众所周知,造血干细胞天然存在于骨髓微环境中,具有骨髓归巢的固有特性,对维持正常的造血和免疫系统功能起着重要作用。因此,我们建议通过将HSPC细胞膜与脂质体相结合,来制备仿生囊泡,以便将抗白血病药物递送至骨髓。
在本研究中,团队通过向HSPC细胞膜注入脂质体,来制备骨髓靶向仿生囊泡。在患有白血病的小鼠中,纳米颗粒在骨髓中安家并积聚。加载抗白血病化疗药物阿糖胞苷(Ara-C)后,白血病细胞的凋亡和分化显著增加,白血病干细胞比例和集落形成能力明显降低。在动物实验中,白血病小鼠的存活时间显着延长。从机制上讲,通过质谱分析表面蛋白,CD44-透明质酸和ITGB2-ICAM-1之间的相互作用,分别介导仿生囊泡对骨髓和白血病细胞的靶向。最后,团队验证了HSPC脂质体在小鼠中是安全的。
研究进展
02
HSPC-Lipo的合成与表征
团队通过磁激活细胞分选(MACS)从6-8周龄C57BL / 6小鼠的骨髓中分离HSPC(LincKit),通过反复冻融循环收集HSPC细胞膜,并与脂质体(HSPC-Lipo)融合。然后,团队进行了HSPC-Lipo囊泡的表征和检测。透射电子显微镜(TEM)显示均匀的杯形形貌,仿生囊泡表面光滑。动态光散射(DLS)测量显示,HSPC-Lipo的平均尺寸为≈178.8 nm,这与TEM的结果一致。HSPC-Lipo在不同的储存温度和培养基条件下,保持稳定。zeta电位结果表明,HSPC-Lipo具有负表面电荷,这促进了囊泡的长期稳定性。此外,傅里叶变换红外光谱(FTIR)显示出与HSPC膜相似的光谱,在1,500cm处检测到酰胺键-+−1的波长。CD44在HSPC膜上表达,但在脂质体上不表达,表明HSPC膜具有特异性标记。此外,绿色和红色荧光信号,在HSPC-Lipo材料中实现了共定位。总之,这些数据表明,HSPC细胞膜已成功嵌入HSPC-Lipo中。
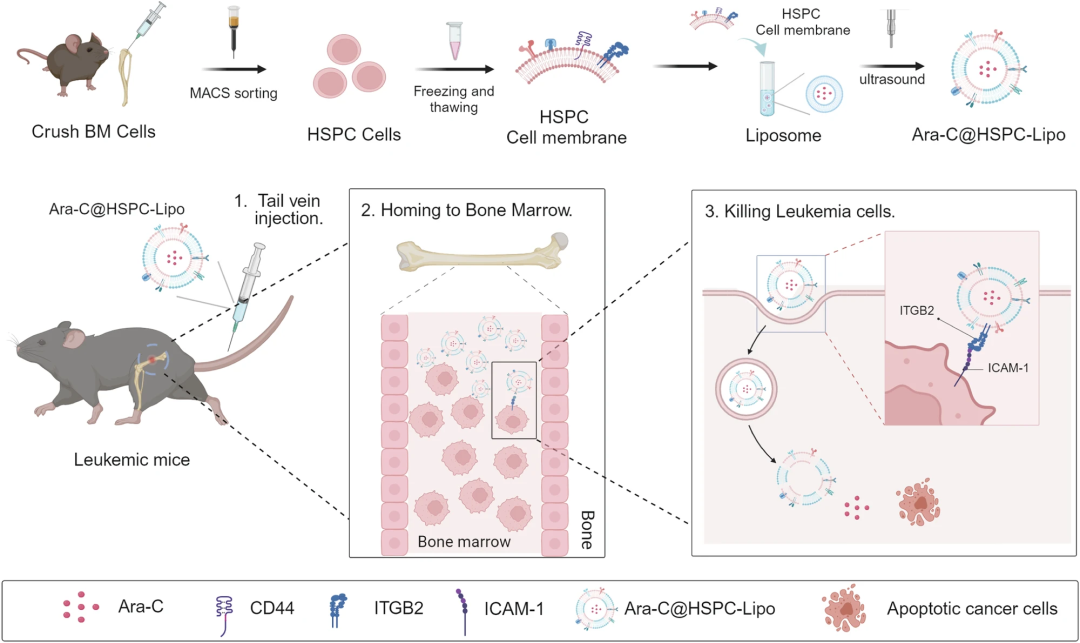
造血干细胞和祖细胞膜包被囊泡(HSPC-Lipo)的产生和抗白血病治疗示意图。
HSPC-Lipo通过CD44-透明质酸相互作用,
促进靶向白血病小鼠的骨髓
为了研究HSPC-Lipo纳米颗粒特异性靶向白血病小鼠骨髓的细胞和分子机制,团队进行了质谱分析,以绘制HSPC-Lipo纳米颗粒和HSPC细胞膜的蛋白质组学。HSPC-Lipo和HSPC细胞膜的蛋白质亚型分类和比例相似。实验结果显示,CD44表达显著降低。综上所述,HSPC-Lipo上的CD44,通过与透明质酸相互作用,介导对白血病小鼠骨髓的特异性靶向,透明质酸在白血病骨髓生态位中高度分布。
HSPC-Lipo上的ITGB2直接与ICAM-1结合,
并靶向白血病细胞
首先,为了证明HSPC细胞膜的特异性,团队使用了4种不同的白细胞膜包被脂质体,作为对照。结果表明,与其他细胞膜相比,HSPC细胞膜制备的囊泡,对白血病细胞的靶向能力最高。相比之下,与小鼠祖细胞系(32D)的结合能力,显著低于白血病细胞。实验结果表明,HSPC-Lipo通过ICAM-1-ITGB2相互作用,与白血病细胞结合。
HSPC-Lipo囊泡的载药量和体外抗白血病作用
团队用化疗药物Ara-C加载HSPC-Lipo囊泡,并在体外测量Ara-C@HSPC-Lipo的药物负载效率,及其抗白血病作用。团队检测了HSPC-Lipo在48小时和72小时的载药效率和药物释放动力学,发现HSPC-Lipo的药物释放率,显著低于其他对照组,显示出持续的药物释放能力。实验结果表明,用Ara-C@HSPC-Lipo治疗后,B220高群体白血病干细胞的频率,显著降低。综上所述,Ara-C@HSPC-Lipo在体外,表现出优异的抗白血病效果。
Ara-C@HSPC-Lipo体内抗白血病作用
团队在2种不同的白血病小鼠模型中,验证了Ara-C@HSPC-Lipo的抗白血病作用。实验结果显示,与其他对照组相比,用Ara-C@HSPC-Lipo治疗的白血病小鼠的生存期,显著延长。将HSPC膜,添加到Ara-C负载脂质体中,可能使BM中LSC的靶向特异性,提高约5倍;在外周血中,白血病细胞的特异性,提高约1.4倍。当使用低剂量游离化疗药物作为对照治疗时,Ara-C@HSPC-Lipo也表现出良好的治疗效果。综上所述,Ara-C@HSPC-Lipo在体内,表现出良好的抗白血病效果。
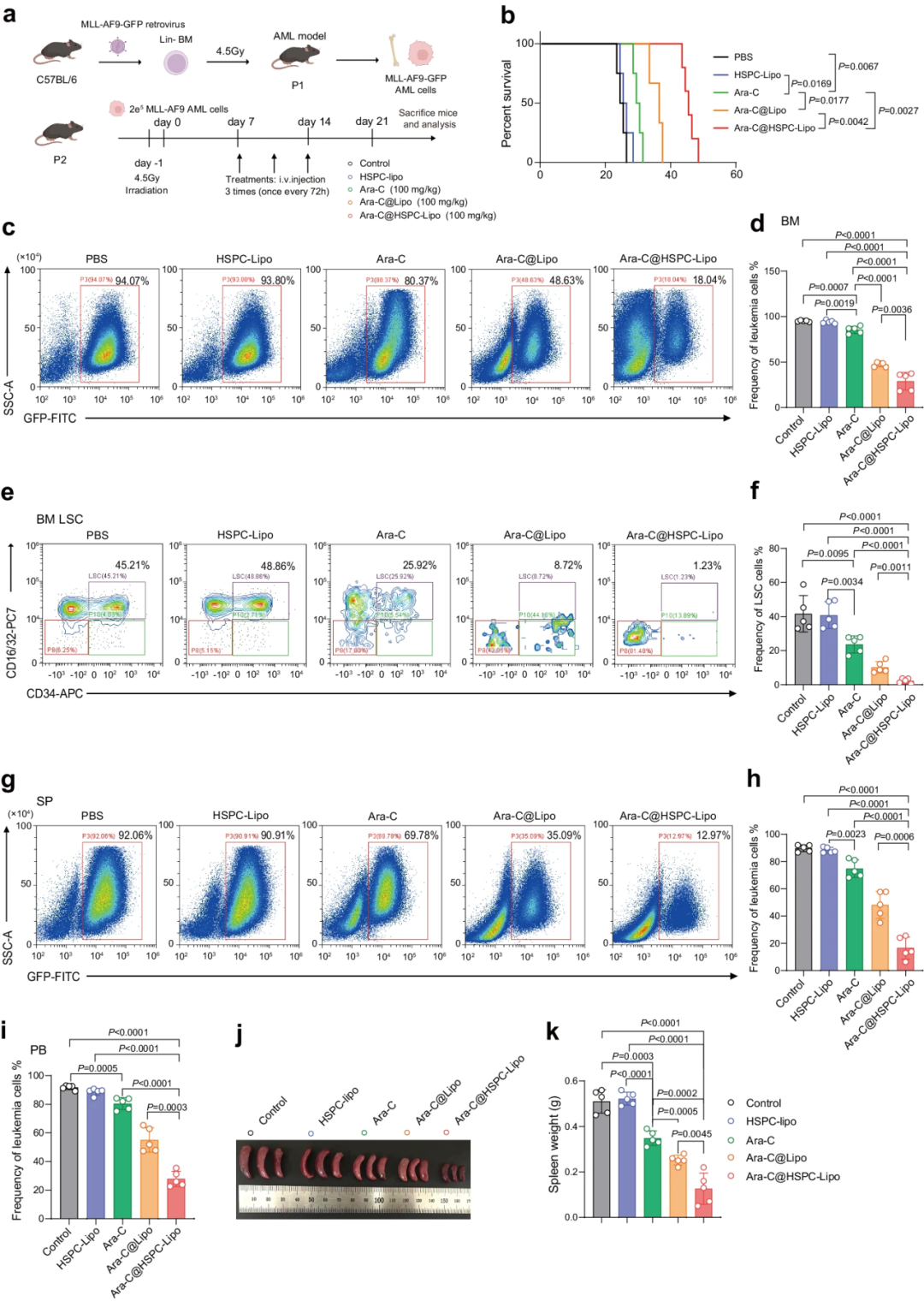
Ara-C@HSPC-Lipo在MLL-AF9白血病小鼠模型中的抗白血病作用。
研究结论
03
骨髓靶向递送药物,是治疗白血病的一种有前途的策略。在本研究中,团队制备了HSPC仿生囊泡,以特异性地,将抗白血病药物输送到骨髓中。脂质体作为临床上应用最广泛的递送系统之一,具有较高的生物相容性、灵活的载药能力和可控的药物释放。本研究结合了HSPCs细胞膜的脂质体和靶向能力的优势,通过将HSPC细胞膜注入脂质体中,构建了仿生囊泡。仿生囊泡在白血病小鼠的骨髓中显著积累,并显示出对白血病细胞的特异性亲和力。因此,HSPC-Lipo在有效携带和递送Ara-C后,增强了白血病细胞的毒性,延长了白血病小鼠的存活期。
HSPC表面的粘附分子或受体,在介导归巢过程中,起着关键作用。在本研究中,通过WB实验结果,验证了HSPC-Lipo中CD44的存在。透明质酸是CD44的经典配体,研究表明,白血病患者骨髓中HA的含量,显著增加。相应地,团队验证了白血病小鼠骨髓中HA的含量,明显高于正常小鼠,证实了CD44-HA轴,参与介导HSPC-Lipo的骨髓靶向。团队在HSPC-Lipo中鉴定了细胞粘附分子ITGB2,它参与细胞粘附和表面信号转导,并在细胞粘附和识别中,起着重要作用。ICAM-1和ITGB2被记录为配体受体。团队发现,ICAM-1在小鼠和人白血病细胞系中高表达,但在骨髓造血干细胞中低表达。表明纳米颗粒表面的粘附分子,是介导白血病细胞特异性靶向的重要原因。
本研究在体外和体内测试了HSPC-Lipo的载药效率和抗白血病能力。细胞分化、成熟和LSCs的频率,是评价白血病治疗效果的重要指标。通过体外毒性实验发现,负荷HSPC-Lipo处理后,白血病细胞凋亡和分化显著增加,LSC比例显著降低;这表明,Ara-C@HSPC-Lipo具有优越的治疗效果。随后的动物实验结果也证实,用Ara-C@HSPC-Lipo治疗的白血病小鼠的存活期,显著延长。HSPC-Lipo囊泡能否刺激免疫系统,并形成长期免疫记忆,值得进一步研究。
本研究构建了靶向骨髓的HSPC仿生囊泡,显著增加了白血病小鼠骨髓的积累,发挥特异性有效的抗白血病作用。本研究为白血病的治疗提供了途径,为其他骨髓源性疾病的靶向治疗提供了参考。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


