Nature重磅:AI模型发现全新抗生素类型,安全高效杀死超级耐药菌,还能加速抗衰老药物发现
来源:生物世界 2023-12-22 10:56
发现一种新型抗生素类别是一个突破性成果,表明了人工智能和可解释的深度学习模型具有独特的加速药物发现的能力。这项研究公开了几个高性能模型,可以准确预测抗生素的活性和对人类细胞的毒性。
该研究利用人工智能(AI)和可解释的深度学习模型,从超过1200万种化合物中识别出一种革命性的新型抗生素类型,可以杀死临床上常见的超级细菌——耐甲氧西林金黄色葡萄球菌(MRSA)。而且,这些化合物对人类细胞的毒性很低,因此成为特别好的抗生素候选者。
这项新研究的一个关键创新在于,研究人员弄清楚了深度学习(Deep Learning)模型使用了哪些信息来预测其抗生素效力。这种知识还可以帮助研究人员设计出更有效的其他治疗药物。

抗生素人工智能项目
这项发表在 Nature 的最新研究,是麻省理工学院抗生素人工智能项目的一部分,该项目由 James Collins 教授领导,计划在七年时间内发现针对七种致命细菌的新类型抗生素。
耐甲氧西林金黄色葡萄球菌(MRSA)是一种临床上常见的超级细菌,通常导致皮肤感染或肺炎,严重病例还会出现败血症甚至死亡。
在过去几年中,James Collins 教授团队开始开始利用人工智能(AI)技术来寻找新型抗生素,以解决日益严重的抗生素耐药问题。
2020年2月,James Collins 教授团队在 Cell 期刊发表论文【2】,开发了首个由人工智能发现的抗生素——halicin,其在结构上与传统抗生素不同,对多种耐药菌显示出杀菌活性。

在这篇 Cell 论文中,研究团队训练了一种机器学习算法来识别可以抑制大肠杆菌的化合物,从包含超过1亿种分子的化合物库中找到了一种化合物,研究团队将其命名为halicin(致敬了经典科幻电影《2001太空漫游》中的AI系统HAL9000)。halicin不仅可以杀死大肠杆菌,还可以杀死其他几种耐药菌。
2023年5月,James Collins 教授团队在 Nature Chemical Biology 期刊发表了题为:Deep learning-guided discovery of an antibiotic targeting Acinetobacter baumannii 的研究论文【3】。
该研究使用人工智能(AI)算法,发现了一种新型抗生素——abaucin,其能够特异性杀死重要的耐药菌——鲍曼不动杆菌(Acinetobacter baumannii)。

这种新型抗生素abaucin可以治疗鲍曼不动杆菌引起的伤口感染。此外,它还能有效杀死从人类患者身上分离出来的多重耐药性鲍曼不动杆菌菌株。进一步实验表明,abaucin通过干扰脂蛋白运输来杀死细菌,脂蛋白运输是细胞将蛋白质从细胞内部运输到细胞包膜的过程。具体来说,abaucin似乎抑制了参与脂蛋白运输过程的LolE酶。
可解释的深度学习模型
在这些研究中,候选化合物是使用深度学习模型识别的,这些模型可以学习识别与抗菌活性相关的化学结构。然后,这些模型筛选数百万其他化合物,生成哪些化合物可能具有强大的抗菌活性的预测。
这些针对候选化合物的搜索已被证明是富有成效的,但这种方法的一个限制是用于搜索的深度学习模型是个“黑匣子”,这意味着没有办法知道模型基于什么特征进行预测。如果科学家们知道模型是如何进行预测的,那么就可能更容易地识别或设计额外的抗生素。

论文第一作者-Felix Wong
这篇 Nature 论文的第一作者 Felix Wong 博士表示,在这项研究中,我们的目标是打开这个“黑匣子”,这些模型是由大量模拟神经连接的计算组成,没有人真正知道背后发生了什么。
首先,研究团队使用大量扩展的数据集训练了一个深度学习模型。他们通过测试约39000种化合物对耐甲氧西林金黄色葡萄球菌(MRSA)的抗生素活性来生成这个训练数据,然后将这些数据以及化合物的化学结构信息输入模型。
Felix Wong 博士表示,基本上,你可以将任何分子表示为化学结构,并告诉模型该化学结构是否抗菌,该模型在许多这样的例子上进行训练。如果你给它任何新的分子——一种新的原子和化学键的排列,它可以告诉你该化合物被预测为抗生素的概率。
为了弄清楚模型是如何做出预测的,研究团队采用了一种名为蒙特卡罗树搜索(The monte carlo search tree)的算法,该算法已被用于帮助其他深度学习模型(例如AlphaGo)变得更易解释。这种搜索算法使模型不仅可以评估每个分子的抗菌活性,还可以预测分子的哪些亚结构可能导致了这种活性。
为了进一步缩小候选药物的范围,研究团队训练了三个额外的深度学习模型,以预测这些化合物是否对三种不同类型的人类细胞有毒性。通过将这一信息与抗菌活性预测相结合,他们发现了一些化合物——既可以杀死细菌,同时又只对人体产生最小的不良影响。
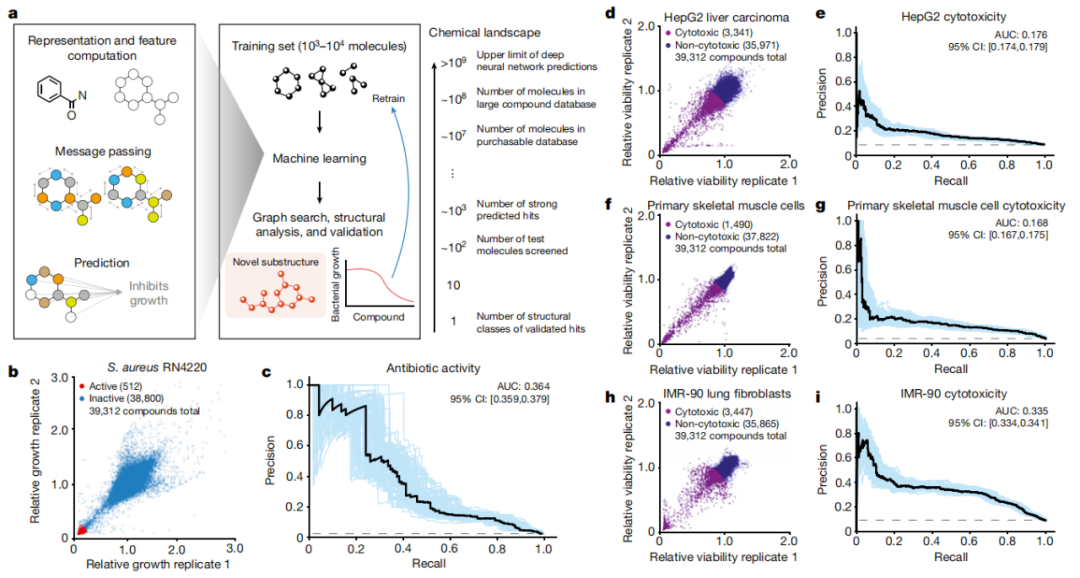
预测抗生素活性和对人类细胞毒性的深度学习模型集合
使用这些模型,研究团队筛选了大约1200万种化合物,所有这些化合物都是商业上可获得的。这些模型根据分子内的化学亚结构识别了来自五个不同类别的化合物,这些化合物被预测对耐甲氧西林金黄色葡萄球菌(MRSA)具有活性。
研究团队对模型识别和筛选的283种候选化合物进行了进一步试验验证,对在培养皿中生长的MRSA进行了测试,进而识别出两个来自同一类别的化合物(化合物1、化合物2),它们似乎是非常有前景的抗生素候选者。
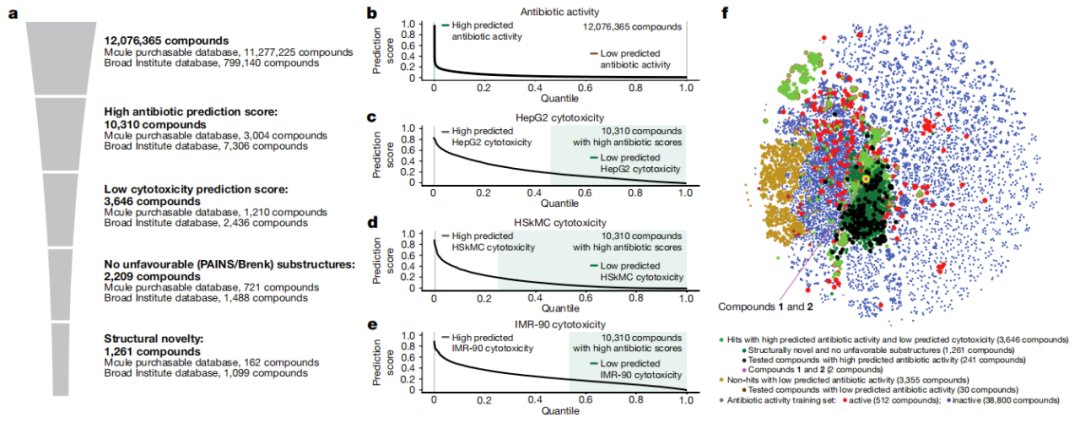
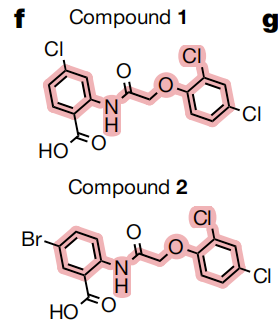
筛选到的化合物1和2
然后,研究团队在两种小鼠模型中进行了体内实验验证,一个是MRSA皮肤感染小鼠模型,另一个是MRSA系统感染模型。结果显示,这些化合物中的每一个都将MRSA数量减少了10倍。这些结果表明,这些化合物在局部和全身都有效,适合进一步开发并用于治疗严重的、败血症相关的耐药菌感染。
实验结果表明,这些化合物似乎通过破坏细菌维持细胞膜电化学梯度的能力来杀死细菌。这种梯度对于许多关键的细胞功能是必需的,包括产生ATP的能力。该团队于2020年发现的一种抗生素候选物halicin似乎也是通过类似的机制发挥作用,但其只针对革兰氏阴性菌(细胞壁较薄的细菌)。而MRSA是一种革兰氏阳性菌,具有较厚的细胞壁。
Felix Wong 博士表示,我们有相当有力的证据表明,这种新的结构类别通过选择性地消耗细菌中的质子动能来对革兰氏阳性病原体产生抗生素活性,这些分子选择性地攻击细菌细胞膜,而不对人类细胞膜造成实质性损害。我们大幅增强的深度学习方法使我们能够预测这种新的抗生素结构类别,并发现它对人类细胞无毒。
总的来说,该研究使用人工智能和可解释的深度学习发现了一种突破性的新型抗生素类别,这是60年来的第一次。这种新类别抗生素对多重耐药病原体有效,展示了人工智能在革命性药物发现和抗击抗生素耐药性方面的巨大潜力。
对未来药物研发的启示
发现一种新型抗生素类别是一个突破性成果,表明了人工智能和可解释的深度学习模型具有独特的加速药物发现的能力。这项研究公开了几个高性能模型,可以准确预测抗生素的活性和对人类细胞的毒性。重要的是,这是第一批展示深度学习模型可以解释它们所预测的内容的案例之一,对药物发现的方式和我们如何使用人工智能高效地发现新药物具有直接和深远的影响。
值得一提的是,Felix Wong 博士、James Collins 教授等人在2022年9月,创立了一家名为 Integrated Biosciences 的公司,该公司通过结合合成生物学和深度学习来控制细胞应激反应,以实现下一代治疗。
细胞应激反应导致了包括神经退行性疾病、癌症、糖尿病、骨关节炎和其他年龄相关疾病。其专有的合成生物学技术,可以虚拟激活细胞应激反应,发现针对应激细胞的药物,并快速识别药物靶点。他们还开发了下一代深度学习方法来识别小分子,这将加快药物发现速度。开发针对应激反应的小分子药物,将有助于促进健康老龄化。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


