《细胞》:揭秘全新阿尔茨海默病病理机制!UCSD团队发现PHGDH或可作为潜在治疗靶点
来源:奇点糕 2025-04-27 10:43
PHGDH表达改变可以调节AD病理学,促进星形胶质细胞中IKKa和HMGB1的转录,从而抑制自噬并加速淀粉样蛋白病理,靶向PHGDH转录功能的小分子抑制剂能够减少淀粉样蛋白病理,改善AD相关行为缺陷。
晚发型阿尔茨海默病(LOAD)患者没有已知的早发型AD或原发性tau蛋白病相关突变,例如APP、PSEN和MAPT突变。另外,也有超过一半的LOAD患者不携带高风险的APOE4等位基因,携带TREM2等位基因的就更少了。然而,几乎所有65岁及以上的人都会发展出不同程度的AD病理。
缺乏确定性的遗传标志物让许多研究人员将目光放到了表观遗传生物学生物标志物上,希望能够帮助进行早期诊断和了解LOAD在一般人群中的发展过程。
磷酸甘油酸脱氢酶(PHGDH)就这样引起了关注,与β-淀粉样蛋白(Aβ)和磷酸化tau(p-tau)不同,它们涉及到翻译后加工、修饰或聚集化的蛋白形式,而PHGDH的蛋白和RNA表达水平都与LOAD有关联,并且在多个患者队列和脑区中得到重复验证。
在《细胞》杂志上,美国加州大学圣地亚哥分校的研究团队发表最新研究成果[1]。
他们发现,PHGDH的表达改变可以调节AD病理学,与其作为酶的活性无关,它在转录调控中发挥作用,促进星形胶质细胞中IKKa和HMGB1的转录,从而抑制自噬并加速淀粉样蛋白病理,靶向PHGDH转录功能的小分子抑制剂能够减少淀粉样蛋白病理,改善AD相关行为缺陷。
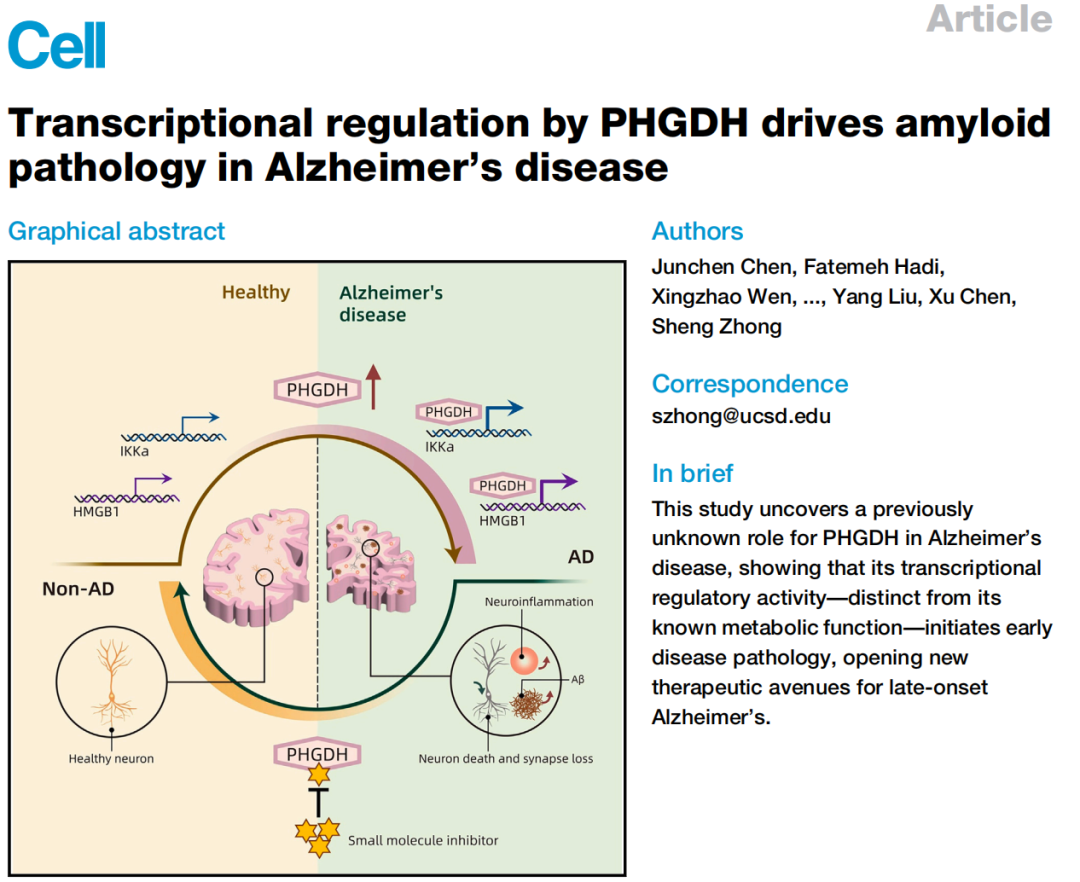
PHGDH是合成丝氨酸所需的酶,在大脑中,它在神经胶质细胞中特异性表达,包括产生丝氨酸的星形胶质细胞。研究人员发现,诱导3xTg-AD小鼠的星形胶质细胞过表达PHGDH,会使Aβ水平显著升高,而p-tau没有变化。
在野生型小鼠中他们也观察到了这一现象,也就是说,即使没有早发型AD相关突变,PHGDH过表达也会诱导Aβ积累。但p-tau水平没有变化,即PHGDH表达的改变不足以完全复制LOAD病理学的所有内容。
使用人胚胎干细胞衍生的人脑类器官暴露于10%人血清(模拟衰老大脑的血脑屏障渗漏)后,出现显著的Aβ聚集体和其他LOAD病理。在这个模型中,研究人员观察到代表星形胶质细胞区域的PHGDH表达显著升高,与之前在患者队列中的发现一致。并且使用β-分泌酶抑制剂处理减少Aβ后逆转了PHGDH的升高,而GSK-3抑制剂减少p-tau则没有这种效果。
使用靶向PHGDH的短发夹RNA显著减少了Aβ聚集、突触丢失和细胞凋亡,同时,没有减少p-tau。
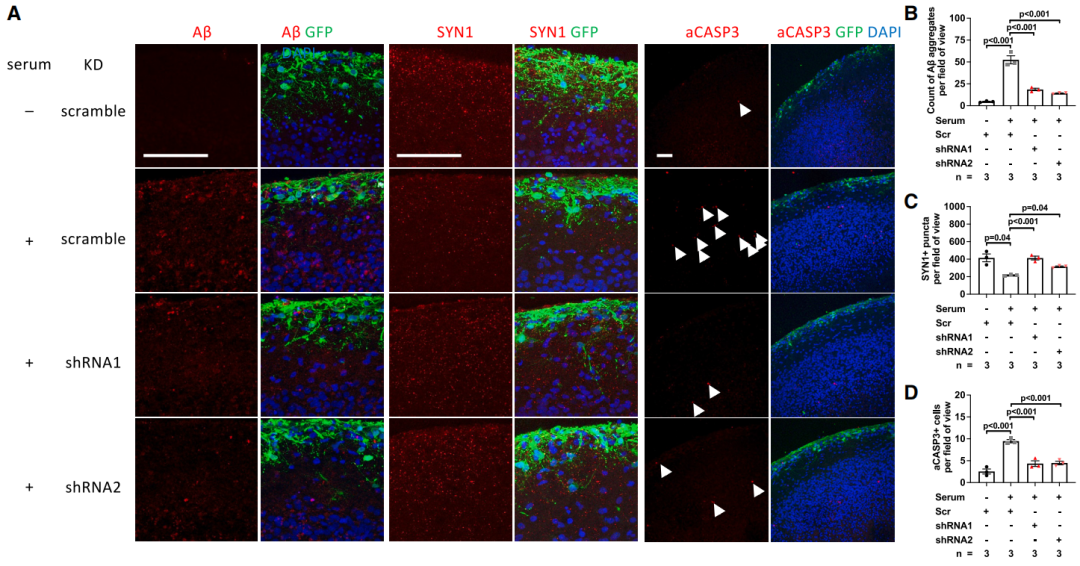
短发夹RNA处理后,Aβ聚集、突触丢失和细胞凋亡情况
由于PHGDH的脱氢酶身份,研究人员第一时间想到,它对LOAD病理变化的影响可能与其酶的功能有关。然而,实验结果并非如此,利用突变制造PHGDH失活后,PHGDH过表达诱导的LOAD病理没有得到改善。
一些催化酶具有次要的非催化功能,研究人员又瞄准这个方向进行探索,他们发现,PHGDH在人脑类器官、小鼠神经干细胞及其衍生的星形胶质细胞中均表现出部分核定位(蛋白质通过核定位序列被转运至细胞核),通过核定位,获得了转录调控能力,诱导和抑制基因表达。
在此基础上,研究人员找到了PHGDH的靶基因,星形胶质细胞中的核因子κ-B激酶α亚基抑制因子(IKKa)和高迁移率族蛋白B1(HMGB1),PHGDH可以激活它们的启动子,正向调节二者的表达。
IKKa和HMGB1已经被证明可以促进核因子κ-B(NF-κB)活性,激活雷帕霉素靶标(mTOR)来抑制自噬,而星形胶质细胞的NF-κB活化和自噬缺陷等变化通常在AD发展中先于其他病理发生,它们也会导致细胞外Aβ水平增加,加剧Aβ诱导的神经元死亡。
在本次的实验中,研究人员也发现,星形胶质细胞中的PHGDH激活刺激IKKa和HMGB1,进而诱导NF-κB和mTOR,同时抑制自噬。在过表达PHGDH的星形胶质细胞中,敲低IKKa和HMGB1有效减轻了AD病理,包括Aβ聚集体减少、突触蛋白1(SYN1)增加和凋亡细胞减少。
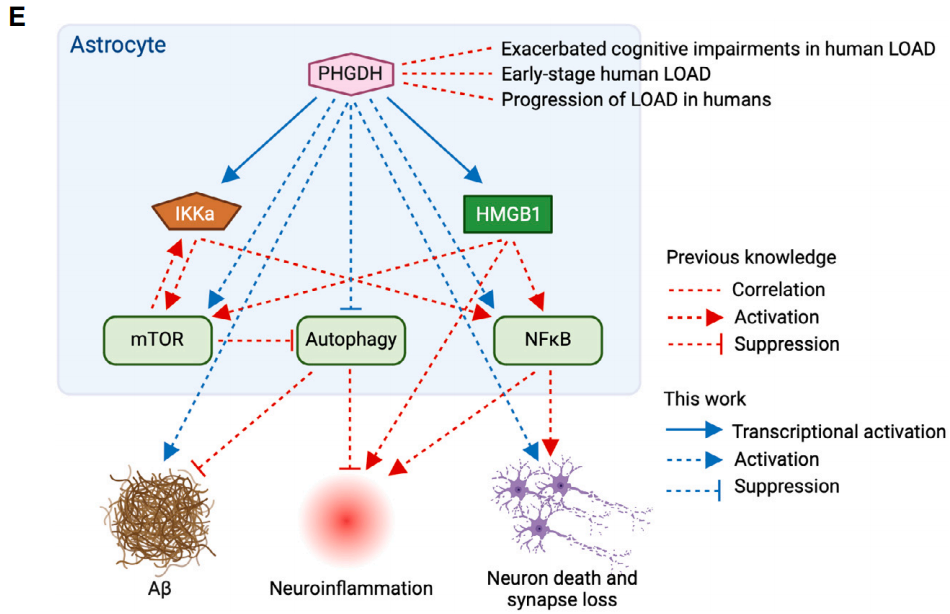
PHGDH对IKKa和HMGB1的调节
研究人员接下来测试了PHGDH酶功能的小分子变构抑制剂NCT-503和PKUMDL-WQ-2101是否能够影响PHGDH的启动子结合和转录调节活性。他们发现,二者中只有NCT-503具有这种功能。
接下来发生的一切就顺理成章了,NCT-503改善了LOAD人脑类器官中的AD病理,Aβ聚集体的数量和覆盖面积减少,SYN1表达增加,凋亡细胞减少。这些结果也在AD小鼠中观察到,同时,根据旷场测试和Barnes迷宫测试表现的变化,小鼠的AD相关行为缺陷也得到改善。
综上所述,这项研究揭示了PHGDH和淀粉样蛋白病理学之间的因果关联,独立于已知的疾病相关突变或风险等位基因,证实了PHGDH作为LOAD重要生物标志物的潜力,并且提出了靶向PHGDH的转录调节功能可能是一种有前途的AD治疗策略。
参考文献:
[1] Junchen Chen, Fatemeh Hadi, Xingzhao Wen, et al. Transcriptional regulation by PHGDH drives amyloid pathology in Alzheimer’s disease. Cell. DOI: 10.1016/j.cell.2025.03.045
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


