Cell:新型PROTAC,首次实现细菌内靶蛋白降解,可作为新型抗菌剂
来源:北京生物结构前沿研究中心 2022-06-23 15:43
细菌感染每年导致数十万人死亡,尤其在中低收入国家。
细菌感染每年导致数十万人死亡,尤其在中低收入国家。考虑到过去50年来仅有少量抗生素获批,新抗生素的发展还面临着细菌包膜的低渗透性以及特异性靶标少的挑战。病原体对现有药物产生耐药性的速度进一步加剧了寻找有效抗菌剂的困难。鉴于这种不平等的军备竞赛,细菌性流行病的卷土重来是一个很大的威胁,迫切需要对抗感染的创新战略。
药物发现中的一个新兴概念是诱导降解靶蛋白。对于真核生物来说,泛素-蛋白酶体系统是细胞内蛋白质降解的主要途径,参与细胞内 80% 以上蛋白质的降解。泛素对蛋白质来说无异于“死神来了”,一旦被盯上,终将被摧毁。
最突出的合成“降解剂”是蛋白水解靶向嵌合体(PROTAC):双功能小分子,包括 E3 泛素连接酶结合部分和靶蛋白(POI)结合的化学部分。PROTAC 通过使 E3 连接酶和 POI 接近,促进 POI 泛素化和随后的蛋白酶体降解。
与经典抑制剂相比,蛋白质降解剂具有多种优势。例如,基于此种催化模式,它们表现出更高的降解效率。此外,PROTAC 几乎可以靶向任何细胞蛋白质,并且它们两个端口可以进行模块化改造,允许改造蛋白质配体以设计出针对特异性靶蛋白的“降解剂”。
尽管有这样的希望,PROTAC 技术迄今为止仅限于真核生物的泛素标记系统,尚未转移到细菌的降解途径中。实现细菌内的靶蛋白降解将为设计蛋白质功能调节剂和开发新型抗菌剂提供有吸引力的策略。
近日,奥地利维也纳分子病理学研究所的 Tim Clausen 实验室与德国杜伊斯堡-埃森大学的 Markus Kaiser 实验室合作,在 Cell 期刊发表了题为:BacPROTACs mediate targeted protein degradation in bacteria 的研究论文。
该研究开发了一种新型小分子降解剂——BacPROTAC,基于细菌内的 ClpCP 蛋白酶降解系统,实现细菌内的靶蛋白降解,为抗菌剂开发提供了全新策略。

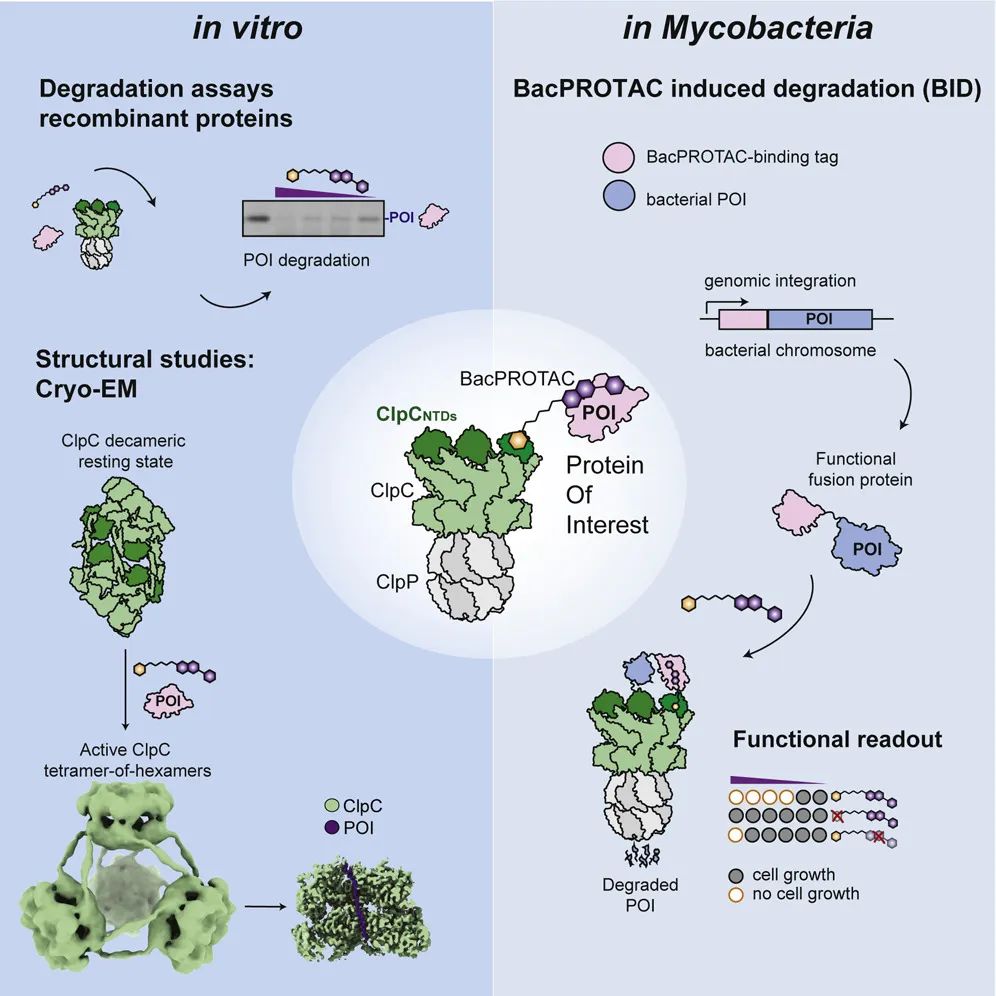
基于 ClpCP 蛋白酶降解系统,研究者以枯草芽孢杆菌 ClpCP 为蛋白降解原件,重新设计了由 POI 配体、化学接头和 ClpCNTD 配体组成的 BacPROTAC。
这种模块化的设计方式理论上可以降解细菌中的任何蛋白质。作为概念验证,研究团队在体外以单体链霉亲和素(mSA)作为模型蛋白,通过连接基团将 pArg(ClpCNTD配体)与生物素(高亲和力mSA配体)结合,形成 BacPROTAC-1 化合物。BacPROTAC-1 可结合 mSA 与 ClpCNTD,形成有活性的三元复合物,在100 μM剂量下可有效降解靶蛋白。
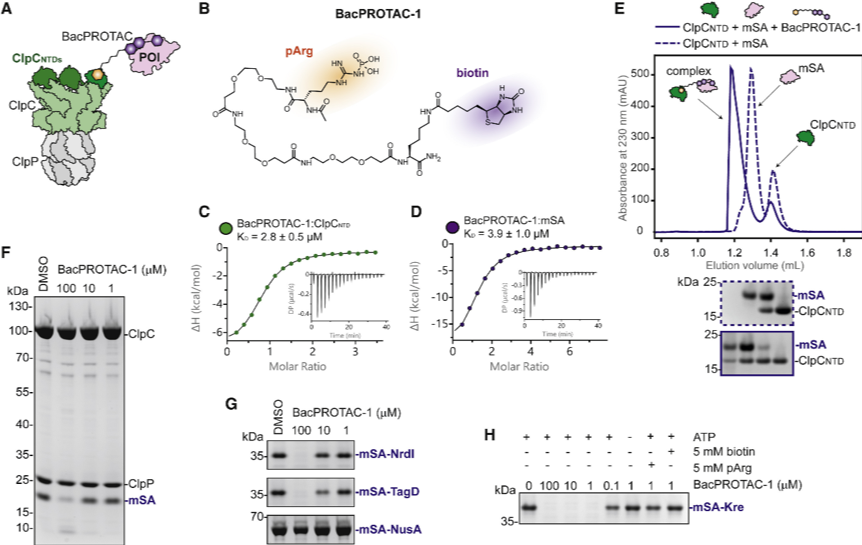
此外,已有研究报道 ClpC 在静息状态下是以一种 AAA 环被破坏的十聚体形式存在。当衔接蛋白 MecA 与 ClpC 相互作用,会促进功能性六聚体的重新组装并激活 ClpCP 蛋白酶。然而尚不清楚大多数用 pArg 标记的 ClpC 底物是如何触发 ClpC 十聚体的重塑。为了阐明这种基于 pArg 识别的激活机制,研究团队对与 BacPROTAC-1 和 mSA-Kre 融合蛋白复合的 ClpC 进行了冷冻电镜结构分析。
结果惊奇地发现,四个 ClpC 六聚体通过它们的盘绕线圈 M 结构域相互作用,排列成几乎完美的四面体对称。此外,为了以更高的分辨率解析激活的去折叠酶的功能单元,研究者还对单个六聚体进行了聚焦的低温冷冻电镜分析,提供了 ClpC 在展开 BacPROTAC 束缚底物过程中的快照。ClpC 24-mer 的结构表明 pArg 标记不仅用作降解信号,而且还介导高阶寡聚体的形成和 ClpC 的激活。开发的含有 pArg 部分的 BacPROTAC 会触发这种重塑机制,因此该双功能小分子不仅可以作为化学接头,而且可以作为 ClpCP 蛋白酶的激活剂。
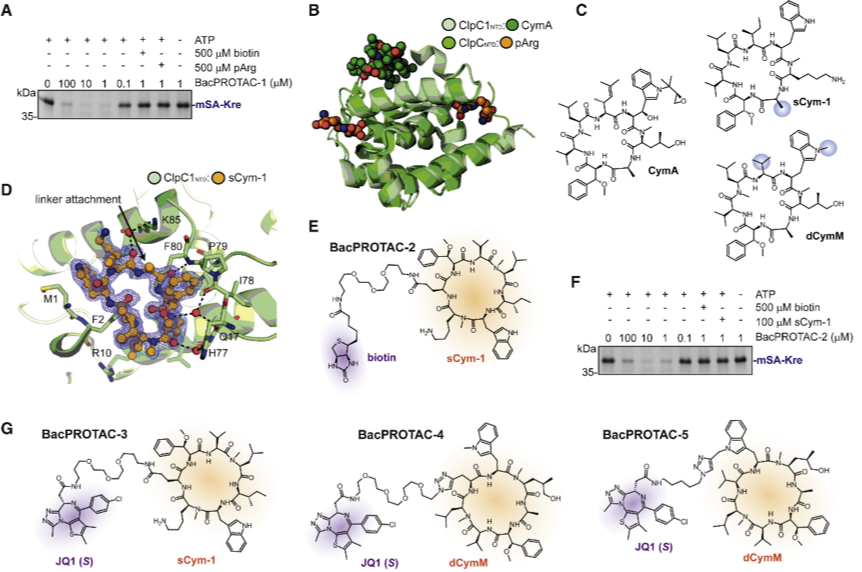
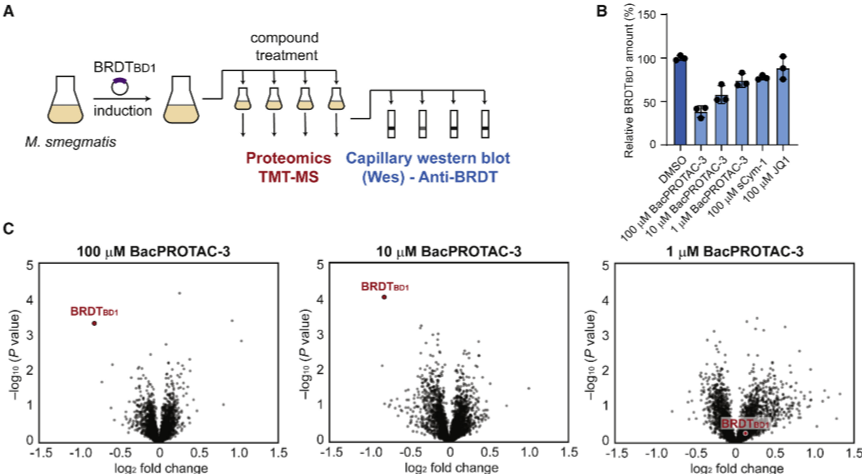
总的来说,该研究开发了一种新的双功能小分子 BacPROTAC,将靶向蛋白质降解技术扩展到细菌。并且鉴于该双功能小分子模块化设计的优势, BacPROTAC 可以开辟新的视野,开发具有高选择性和物种特异性的抗菌剂。此外,BacPROTAC 除了具有新型抗菌剂的潜力外,还可以用于了解细菌蛋白质功能,从而发现新的药物靶标。但是值得一提的是,该研究仍存在靶蛋白体内降解效率低下、BacPROTAC 低细胞渗透性等局限性,还需要进一步优化设计,并证明内源性细菌蛋白可以以相同的方式降解。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


