11月Nature杂志不得不看的重磅级亮点研究!
来源:生物谷原创 2022-11-30 11:21
时间匆匆易逝,转眼间11月份即将结束,在即将过去的11月里,Nature杂志又有哪些亮点研究值得学习呢?小编对相关文章进行了整理,与大家一起学习!
时间匆匆易逝,转眼间11月份即将结束,在即将过去的11月里,Nature杂志又有哪些亮点研究值得学习呢?小编对相关文章进行了整理,与大家一起学习!
【1】两篇Nature:科学家揭示表观遗传学特征在癌症形成和行为发挥中所扮演的关键作用
doi:10.1038/s41586-022-05202-1 doi:10.1038/s41586-022-05311-x
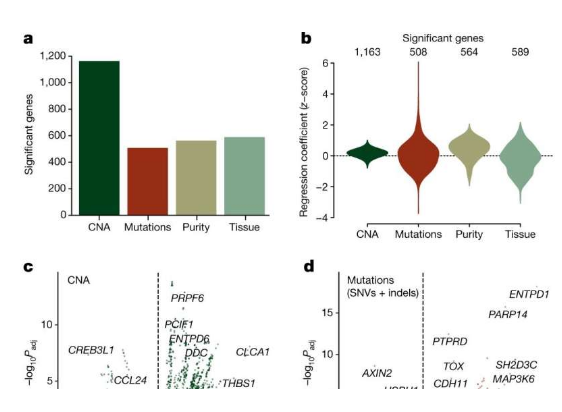
近日,发表在国际杂志Nature上题为“Phenotypic plasticity and genetic control in colorectal cancer evolution”和“The co-evolution of the genome and epigenome in colorectal cancer”的两篇研究报告中,来自伦敦癌症研究所等机构的科学家们通过研究分析了表观遗传学在癌症行为发生过程中所扮演的关键作用。
科学家揭示表观遗传学特征在癌症形成和行为发挥中所扮演的关键作用。
图片来源:Nature (2022). DOI:10.1038/s41586-022-05311-x
文章中,研究人员对来自不同患者机体数千份肠癌样本进行分析来遵照表观遗传学发生变化的实例,他们重点分析了从相同肿瘤组织中提取的多份样本,旨在寻找因表观遗传学特性所发生的改变。多年来,医学科学家们认为,大多数(如果并非全部)癌症的发生都是因为DNA的突变所致,其会导致肿瘤形式的异常组织生长,近年来,研究人员发现有证据表明,并非所有癌症都存在简单的遗传来源,的确,有研究证据认为,一些癌症中确实存在一些表观遗传学因素;通过表观遗传学、年龄或环境对癌细胞中DNA代码的表达方式产生了影响。
在这两篇研究报告中,所有研究人员都希望能更好地理解表观遗传学在癌变肿瘤的发生和进展过程中所扮演的关键角色。在第一篇研究报告中,研究人员收集并分析了来自30种不同患者机体中多种类型的肠癌组织,他们共对1370份组织样本进行了研究,每一份样本都进行了全转录本RNA测序和全基因组测序分析,随后研究人员追踪了哪些肿瘤携带有纯粹的DNA以及哪些没有携带纯粹的DNA,结果发现,仅有166份组织样本能追溯到其基本的遗传学特征。
【2】Nature:揭示细胞中AP-1调节STING蛋白活性机制
doi:10.1038/s41586-022-05354-0
在一项新的研究中,来自瑞士洛桑联邦理工学院(EPFL)的研究人员确定了一种在我们的第一道免疫防线中起着至关重要作用的蛋白如何在细胞中受到调节以防止自身炎症性疾病。细胞如何“知道”它被感染了?这是先天免疫的一个关键问题,我们对任何感染或损伤的第一道防线由快速识别病原体(比如病毒DNA)的细胞组成。要做到这一点,这些细胞使用能够识别核酸的受体来激活一种叫做STING的信号分子。
在一连串级联反应---科学家们称之为信号通路---中,STING在环状GMP-AMP合酶(cyclic GMP-AMP synthase, cGAS)之后开始发挥作用,因此这个完整的信号通路被称为cGAS-STING。它的作用是检测入侵细胞的外来DNA,如来自细菌或病毒的DNA。当外来DNA侵入细胞时,cGAS-STING信号通路开启。STING离开细胞中合成蛋白的内质网,并移动到高尔基体,在那里蛋白经过修饰和最后润色,然后被包装并送往目标目的地。在高尔基体中,一种酶将一些磷酸盐基团附着在STING上---一种称为磷酸化的常见机制,为细胞内的蛋白提供能量。然后STING开始激活基因,开启细胞的防御机制来对抗感染。
鉴于STING对于像先天性免疫这样的关键功能是多么的重要,对它的研究一直很活跃,尤其是EPFL生命科学学院的Andrea Ablasser团队。然而,人们对STING如何受到调节以及它实际上如何阻止基因开启知之甚少---考虑到当STING不起作用时可导致一些严重的自身炎症性疾病,这是一个关键问题。
【3】Nature:揭示癌症中突变过程诱导的单细胞基因组变异
doi:10.1038/s41586-022-05249-0
在一项新的研究中,来自美国威尔康奈尔医学院、纪念斯隆凯特琳癌症中心、加拿大英属哥伦比亚大学和IMAXT联盟的研究人员利用单细胞测序揭示了乳腺癌和卵巢癌相关的突变过程。相关研究结果于2022年10月25日在线发表在Nature期刊上,论文标题为“Single-cell genomic variation induced by mutational processes in cancer”。在这篇论文中,他们描述了他们如何对成千上万个乳腺组织细胞进行单细胞基因组测序,并将他们的发现与他们对成千上万个卵巢肿瘤和乳腺肿瘤细胞样本进行的测序进行比较。
这些作者在注意到可能在多种癌症中引发基因组不稳定的细胞间拷贝数改变还没有被科学界很好地解决后开始了他们的研究。他们还注意到,在不同种类癌症的进化过程中,这种改变能够导致表型变化的方式也没有得到充分的研究。为了纠正这种情况,他们开始了一项雄心勃勃的测序工作,最直接地关注与卵巢癌和乳腺癌有关的突变过程。
这些作者的研究工作是双管齐下的。其中的一项实验涉及对13800个乳腺上皮细胞进行单细胞基因组测序,这些细胞来自可能存在或不存在p53、BRCA1或BRCA2突变的女性,这些突变会导致同源重组缺陷。他们随后通过观察单倍型模式和单细胞结构变异(structural variant)来寻找突变过程。第二项实验是对22057个晚期卵巢癌或乳腺癌的肿瘤细胞进行单细胞基因组测序。他们随后将在第一项实验中发现的模式(他们称之为前景事件)与第二项实验中发现的模式进行了比较。
【4】Nature:揭示急性髓性白血病发生的新型分子机制和潜在的治疗性靶点
doi:10.1038/s41586-022-05365-x
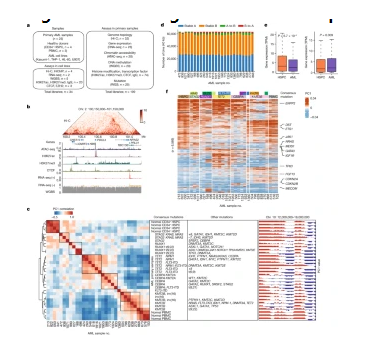
急性髓性白血病(AML,Acute myeloid leukaemia)代表了一组异质性的骨髓性恶性肿瘤,其主要特征包括表观遗传学修饰子、转录因子和激酶的突变,目前研究人员还不清楚AML中的突变到底在多大程度上能驱动染色质3D结构的改变并促进骨髓的转化。近日,一篇发表在国际杂志Nature上题为“Subtype-specific 3D genome alteration in acute myeloid leukaemia”的研究报告中,来自美国西北大学等机构的科学家们通过研究发现,急性髓性白血病患者或许会表现出大规模的基因组突变以及DNA折叠模式的改变,这或许有望帮助识别出潜在的治疗性靶点。
揭示急性髓性白血病发生的新型分子机制和潜在的治疗性靶点。
图片来源:Nature (2022). DOI:10.1038/s41586-022-05365-x
据美国癌症协会数据显示,每年在美国都有超过2万人会被诊断为急性髓性白血病,而且患者的预后较差,5年生存率仅为30%。当骨髓中的骨髓细胞干预其它造血细胞的产生时就会引发急性髓性白血病,这类白血病在不同的患者机体中能表现出不同的基因组突变组合,这些突变会干扰正常的细胞功能,包括调节细胞复制、分化转录的染色质3D结构的组织。不同的急性髓性白血病亚型通常是由这些不同的基因组突变所驱动,这常常会给疗法带来一定的障碍,即不同亚型的患者往往对相同疗法反应不同。
研究者Yue说道,因此,理解这些定义亚型的突变如何通过改变染色质的3D结构来产生白血病细胞表型或许是至关重要的。当前研究中,研究人员利用深度测序和全基因组测序技术对来自急性髓性白血病患者和未患该病的患者机体的血液样本进行分析,结果发现,急性髓性白血病患者机体携带有大规模的基因组改变,这些突变或与白血病细胞中特殊的DNA折叠模式或染色质环有关,对这些样本进行额外的遗传测序结果表明,成千上万的新型环状结构或许能直接控制关键的急性髓性白血病致癌基因。
doi:10.1038/s41586-022-05402-9
结肠癌是世界上第三大最常见的癌症,每年大约有200万新病例。大多数患者在肿瘤还位于结肠或直肠时就被诊断出来了。这些肿瘤通过手术切除,在许多情况下,通过化疗来防止肿瘤复发。然而,对于20%至35%的患者来说,结肠癌会以转移瘤的形式重新出现在其他重要器官中。这些是由手术时仍然隐藏的残余肿瘤细胞引起的。癌症转移是几乎所有类型的癌症的主要死因,包括结肠癌。大多数结肠癌的研究都集中在原发性结肠癌上。近年来,在转移性结肠癌出现后的特征描述方面也取得了重要进展。然而,在此之前,还不可能研究这一小群扩散到体内其他部位的肿瘤细胞,这些细胞在临床上使用的诊断技术中是看不到的。这种知识的缺乏导致缺乏有效的疗法来消除残余的肿瘤细胞并防止预后不佳的转移性结肠癌复发。
如今,在一项新的研究中,来自西班牙巴塞罗那科学技术研究所的研究人员首次发现了隐藏在肝脏和肺部中的残余肿瘤细胞,并描述了它们如何演变为这些器官中出现的转移瘤。相关研究结果于2022年11月9日在线发表在Nature期刊上,论文标题为“Metastatic recurrence in colorectal cancer arises from residual EMP1+ cells”。研究者Eduard Batlle博士说,“了解和避免手术后结肠癌复发的现象是一个尚未解决的医学需求。经过多年对结肠癌的研究,我们在预防出现局部结肠癌的患者发生癌症转移方面已迈出了第一步。”
这些作者开发出一种新的实验小鼠模型,再现了结肠癌复发患者所经历的过程。这通常要经历诊断、手术移除和随后的复发阶段。与此同时,他们还设计了一种技术,可以分离出隐藏在肝脏中的极小部分发生扩散的肿瘤细胞。研究者表示,这种模型与结肠癌复发患者体内的转移性结肠癌进展非常相似,这使得我们能够详细描述残余疾病的动态。我们研究了从3或4个细胞的微观规模到中等规模甚至更大的转移,并详细说明了它们中的每一个细胞在这种疾病进展期间的演变过程。
【6】Nature:首次使用非病毒精确基因组编辑开发出的neoTCR-T细胞在临床试验中治疗实体癌并取得积极进展
doi:10.1038/s41586-022-05531-1
人类免疫系统在T细胞表面上有特定的受体,即T细胞受体(TCR),可以专门识别癌细胞并将它们与正常细胞区分开来。这些受体对每名患者来说都是不同的,因此找到一种有效的方法来分离它们并将它们导入到T细胞中,以产生一种个性化的T细胞疗法来治疗癌症,是使这种方法大规模可行的关键。在一项新的研究中,来自美国加州大学洛杉矶分校和PACT制药公司的研究人员首次使用CRISPR技术将外源基因导入到称为T细胞的免疫细胞中,使得这些经过基因改造的T细胞集中攻击癌细胞,潜在地让正常细胞不受伤害,从而提高免疫疗法的有效性。相关研究结果于2022年11月10日在线发表在Nature期刊上。
CRISPR技术以前曾被用于人体中去除特定的基因,使免疫系统能够更有效地对抗癌症。在这项新的研究中,这些作者开发了一种基于CRISPR/Cas9非病毒精确基因组编辑的临床级方法,同时敲除T细胞中的两个内源性TCR基因:TCRα(TRAC)和TCRβ(TRBC),并在TRAC基因座上插入新抗原特异性TCR(neoantigen-specific TCR, neoTCR)的两条链,所使用的neoTCR是从患者自身的循环T细胞中分离出来的,由此获得的T细胞称为neoTCR-T细胞。
16名难治性实体癌(包括结肠癌、乳腺癌和肺癌)患者首次在neoTCR-T细胞剂量递增的1期临床试验(NCT03970382)中接受了多达三种不同的neoTCR-T细胞输注,每种neoTCR-T细胞都表达了患者特异性的neoTCR。一名患者出现了1级细胞因子释放综合征,一名患者出现了3级脑炎。在接受neoTCR-T细胞输注前,所有患者都接受清除淋巴细胞的化疗,并且在化疗后出现预期的副作用。在接受neoTCR-T细胞输注后,5名患者病情稳定,其他11名患者出现疾病进展。在接受neoTCR-T细胞治疗后的肿瘤活组织中检测到neoTCR-T细胞,其频率高于治疗前表达内源性TCR的T细胞。
【7】Nature:揭示ILC2在保护身体屏障组织免受寄生虫感染和炎症引起的肠道损伤方面起着重要作用
doi:10.1038/s41586-022-05297-6
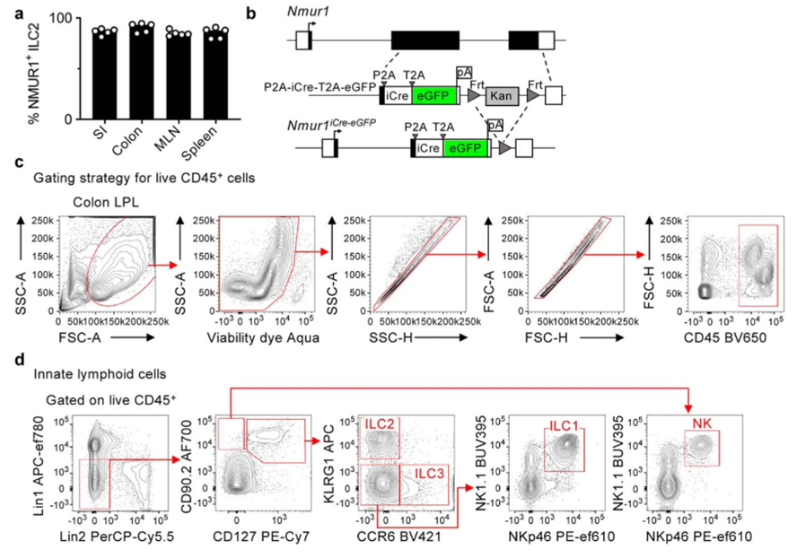
先天性淋巴细胞(ILC)是最近发现的一个白细胞家族,它们存在于皮肤、胃肠道、呼吸道和身体的其他屏障组织中。在一项新的研究中,来自美国威尔康乃尔医学院、西奈山伊坎医学院和德国夏里特医院等研究机构的研究人员发现2型先天性淋巴细胞(group 2 innate lymphoid cell, ILC2)在保护这些屏障组织免受寄生虫感染以及免受与过敏性炎症和哮喘有关的损害方面发挥着重要作用。相关研究结果于2022年11月2日在线发表在Nature期刊上。
NMUR1-eGFP在淋巴组织和非淋巴组织中高度表达并富集于ILC2中
图片来源:Nature, 2022, doi:10.1038/s41586-022-05297-6。
这一发现解决了关于ILC2与体内其他细胞可能存在冗余的争论。这项新的研究还表明,由肠道神经元控制的一组独特的调控网络可能是未来用于对抗慢性炎症性疾病(包括哮喘、过敏和炎症性肠病)的药物疗法的可行靶标。这项新的研究表明,尽管ILC2与称为2型辅助性T细胞(Th2)的免疫细胞有许多功能上的相似之处,但后者的细胞类型不能充分补偿ILC2对肠道内寄生虫感染以及肠道炎症的保护性反应的损失。通过强调了这项新研究的临床意义,这些作者发现了人类ILC2的反应方式与小鼠ILC2相似的证据。
研究者David Artis说,“这促进了我们对免疫系统复杂性的理解,并为我们在未来开发疗法提供了一系列潜在的新靶标。”ILC2是ILC的一部分。由于ILC在屏障组织中的强大存在,它们通常被认为是抵御多种类型感染的哨兵和第一反应者。但科学家们也认识到,ILC可能是理解常见炎症和自身免疫性疾病(如哮喘和炎症性肠病)的关键。人们认为ILC2和Th2细胞的出现至少部分是为了保护身体免受寄生虫感染、昆虫叮咬和其他环境诱因的影响。当遭受这类挑战时,这两者都有助于触发所谓的2型免疫反应。这些相似之处使得科学家们认为它们在功能上几乎是一样的,但ILC2专门触发较早的、更局部的反应,而Th2细胞则更多地在血液中流动,在需要时聚集于多个组织中。
【8】Nature:重大进展!在阿尔茨海默病中,蛋白medin与β淀粉样蛋白相互作用并共同沉积在大脑血管中
doi:10.1038/s41586-022-05440-3
蛋白medin与β淀粉样蛋白(Aβ)一起沉积在阿尔茨海默病患者的大脑血管中。在一项新的研究中,来自德国神经退行性疾病研究中心和图宾根大学等研究机构的研究人员发现了这种所谓的共同聚集现象。相关研究结果于2022年11月16日在线发表在Nature期刊上。
研究者表示,medin已被认识了20多年,但它对疾病的影响以前被低估了。我们能够发现阿尔茨海默病患者血管中的病理变化被medin明显加强。”蛋白medin属于淀粉样蛋白。在这类蛋白中,Aβ最为著名,因为它在阿尔茨海默病患者的大脑中凝结成团。这些聚集物随后既作为所谓的斑块直接沉积在脑组织中,也沉积在它的血管中,从而分别损害了神经细胞和血管。但是,尽管许多研究都集中在Aβ上,medin却没有成为关注的焦点。
Neher解释说,“几乎没有病理学的证据---与medin相关的临床上引人注目的发现,而这往往是对一种淀粉样蛋白进行更深入研究的先决条件。”然而,medin实际上存在于几乎所有50岁以上的人的血管中,使得它成为已知最常见的淀粉样蛋白。Neher和他的团队最初发现medin甚至会在衰老的小鼠中产生,并且在两年前在PNAS期刊上报告了这一发现(PNAS, 2020, doi:10.1073/pnas.2011133117)。
小鼠的年龄越大,大脑血管中积累的medin越多,这是当时的发现。更重要的是,当大脑变得活跃并触发血液供应增加时,存在medin沉积的血管比没有medin的血管扩张得更慢。然而,血管的扩张能力对于以最佳方式向大脑供应氧气和营养物非常重要。
【9】Nature:我国科学家发现THP9能提高玉米种子蛋白含量和氮素利用效率
doi:10.1038/s41586-022-05441-2
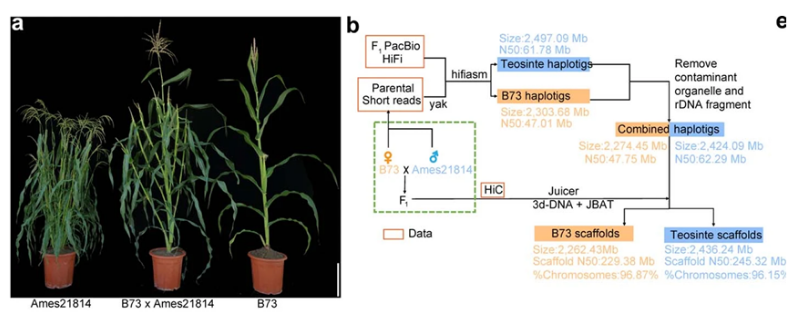
大刍草(teosinte)是玉米的野生祖先,它的种子蛋白含量是大多数现代玉米品系的三倍。在一项新的研究中,来自中国科学院和上海师范大学的研究人员追踪了造成玉米杂交种和近交系中种子蛋白含量下降的机制。他们的发现为在未来的玉米育种中最大化提高种子蛋白含量和质量开辟了新途径,对氮素使用效率和粮食安全有影响。相关研究结果于2022年11月16日在线发表在Nature期刊上。
巫永睿研究员说,“在保持高产玉米的同时减少施入土壤的氮素水平,存在着经济和环境压力。因此,确定提高氮气利用效率的遗传因素是至关重要的。”几千年来,植物育种者对植物物种进行了基因改造,以创造出具有更大比例的代谢物的种子,以提高营养价值和效用。随着玉米成为牲畜饲料的主要来源,植物育种者优先考虑淀粉含量和产量,而蛋白含量和口味则成为次要考虑因素。氮肥的使用进一步降低了种子氮含量的重要性。因此,现代玉米杂交种只含有5~10%的蛋白;相比之下,根据这项新的研究,大刍草的蛋白含量为20~30%。
图片来源:Nature, 2022, doi:10.1038/s41586-022-05441-2。
科学家们可以追踪现代玉米种子蛋白含量的下降,但遗传机制仍然难以捉摸。这些作者着手通过构建完整的大刍草基因组序列来确定造成大刍草和玉米之间蛋白含量差异的基因。通过将大刍草与玉米杂交并分析所产生的后代,他们能够确定数量性状基因座(quantitative trait locus, QTL),即与有关性状相关的特定染色体区域。巫永睿研究员说,“由于现代玉米从大刍草驯化而来,我们推断,对大刍草中负责高蛋白性状的基因进行表征,相比于最近的近交系玉米群体可能会发现一组更加多样化的QTL。这些结果还可能帮助我们了解玉米驯化过程中种子蛋白含量下降的原因。”
doi:10.1038/s41586-022-05395-5
炎症和粘液分泌增加是蠕虫感染和过敏的典型症状。这种免疫反应涉及我们的先天免疫细胞,但它们的确切功能还没有被完全理解。在一项新的研究中,来自德国柏林夏里特医学院的研究人员如今阐明了先天免疫细胞所执行的关键任务。基于此,他们还确定了治疗过敏的潜在治疗方法。相关研究结果于2022年11月2日在线发表在Nature期刊上。
人类免疫系统由两个相互关联的分支组成:适应性免疫系统和先天性免疫系统,前者在每次感染时都会学到新东西,并在一生中不断发育;后者没有那么专业化,但反应特别迅速和有效。先天性免疫系统中的细胞位于呼吸道和肠道的粘膜上,它们在病原体的进入点上形成第一道防线。这些细胞包括2型先天性淋巴细胞(group 2 innate lymphoid cell, ILC2),ILC2在患寄生虫病时在肠道内活跃,在患过敏时在呼吸道活跃。
研究者Christoph Klose博士解释说,“先天性淋巴细胞(ILC)是在十几年前被发现的,我们已经对它们有了很多了解,但它们在免疫系统机制中的确切功能还没有被完全理解。一组适应性免疫细胞---2型辅助性T细胞(Th2)---作为2型免疫反应的一部分执行一些类似的功能,所以以前人们认为ILC2的作用可能是多余的,可以很容易地被Th2细胞所取代。”
然而,这项新的研究如今推翻了这一观点。利用一种动物模型和最先进的分子方法,比如单细胞测序,这些作者阐明了ILC2的核心功能。Klose博士解释说,“当ILC2缺失时,某种类型的免疫细胞---嗜酸性粒细胞---无法正常发育。这种关系以前是未知的,而且是一个很大的惊喜。”(生物谷Bioon.com)
更多精彩阅读:
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


