师从施一公及David Baker,西湖大学卢培龙团队精确从头设计镜像结合蛋白
来源:生物世界 2024-08-21 13:38
该研究设计的D型蛋白质结合物对人工L型多肽以及两种具有治疗意义的天然蛋白质(人TrkA蛋白的D5结构域、人IL-6蛋白)表现出纳摩尔级(nmol)亲和力。
西湖大学卢培龙团队与清华大学刘磊团队合作,在 Cell Research 期刊发表了题为:Accurate de novo design of heterochiral protein–protein interactions 的研究论文。
该研究从头设计了靶向L型蛋白质或L型多肽的特定表面区域的D型蛋白质,这也是首次实现异手性蛋白复合物的精确从头设计。该研究在全面了解异手性蛋白-蛋白相互作用的结构原理方面取得了重大进展,有望最终提高蛋白质设计的成功率。

卢培龙,2009年本科毕业于中国科学技术大学生命学院;2014年博士毕业于清华大学生命学院,师从施一公教授;之后在华盛顿大学进行博士后研究,师从蛋白质设计先驱David Baker教授;2019年加入西湖大学生命科学学院,组建蛋白质设计/合成生物学实验室。
在这项最新研究中,研究团队从头设计了由50-65个氨基酸残基组成的D型蛋白质,旨在靶向L型蛋白质或L型多肽的特定表面区域。
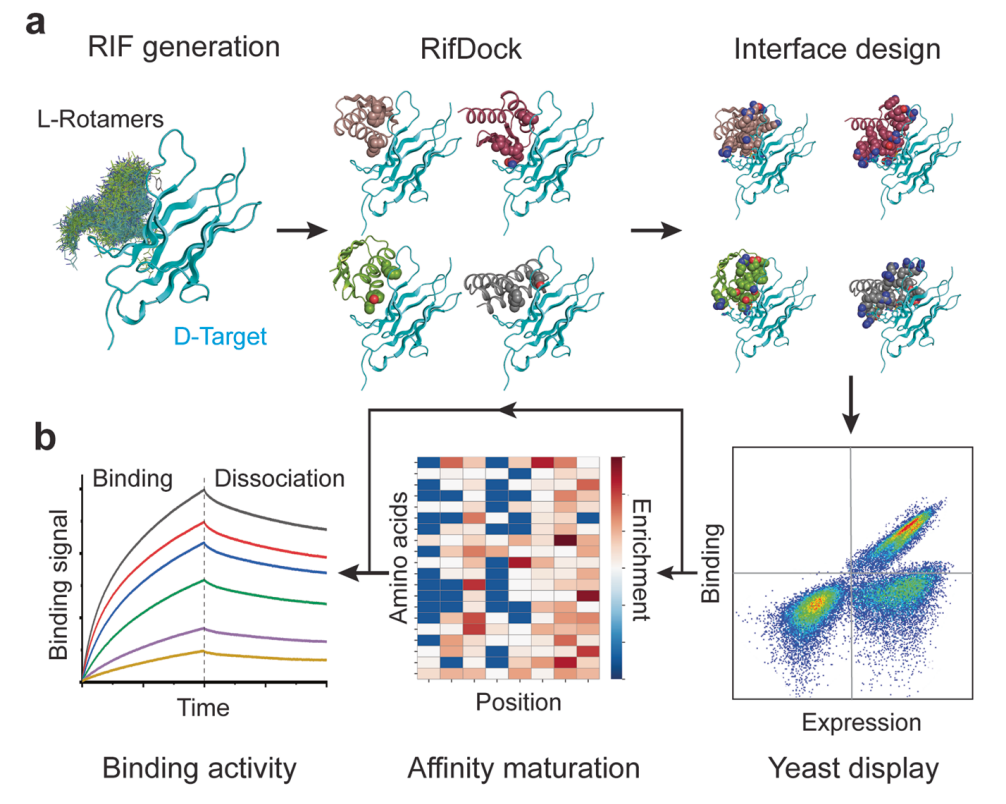
从头设计靶向L型蛋白质的D型蛋白质
该研究设计的D型蛋白质结合物对人工L型多肽以及两种具有治疗意义的天然蛋白质(人TrkA蛋白的D5结构域、人IL-6蛋白)表现出纳摩尔级(nmol)亲和力。值得注意的是,这些D型蛋白结合物具有高度的对映体特异性和靶向特异性。
在基于细胞的实验中,这些从头设计的D型蛋白质结合物有效地抑制了TrkA和IL-6的下游信号转导。此外,这些结合物表现出显著的热稳定性和对蛋白酶降解的抗性。
接下来,研究团队解析了这些从头设计的异手性D型蛋白质-L型多肽复合物(D-19437-L-Pep-1)的2.0 Å的高分辨率晶体结构,结果显示,其结构与设计模型非常相似,表明所研究所采用的计算设计方法具有很高的准确性。
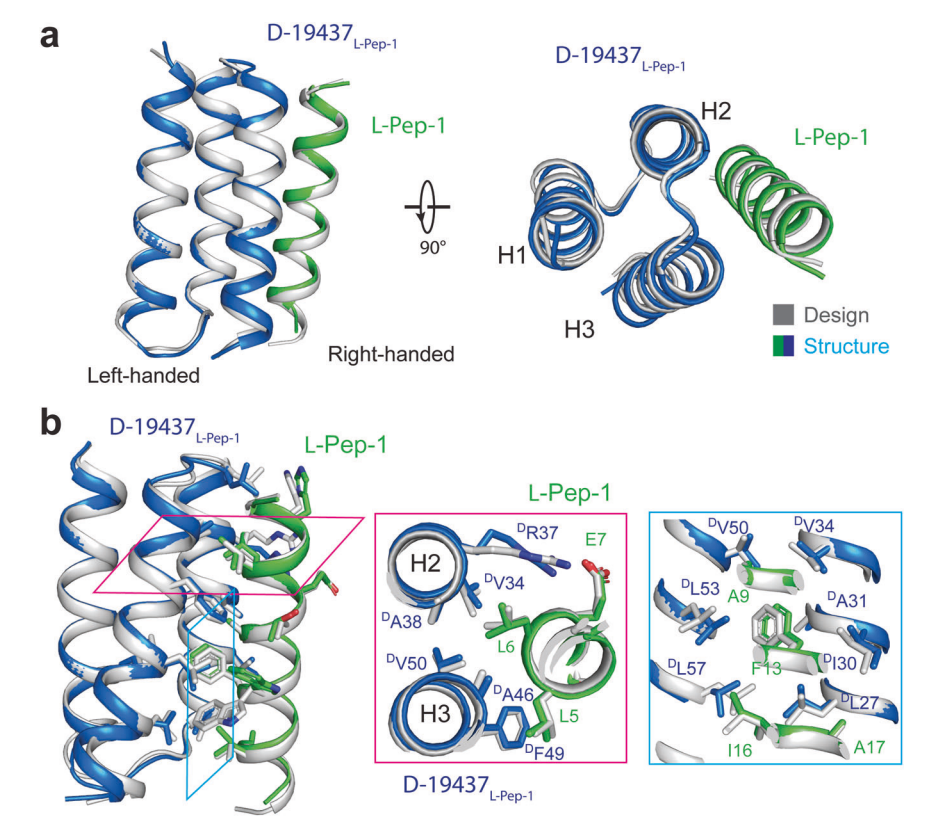
D-19437-L-Pep-1异手性蛋白质复合物的晶体结构与设计模型一致
此外,该晶体结构提供了关于螺旋L型多肽和D型蛋白质之间相互作用的有价值的信息,特别是阐明了一种新的异手性螺旋-螺旋相互作用模式。研究团队表示,利用靶向L型多肽或L型蛋白质的D型蛋白质的设计,为系统地探索镜像蛋白宇宙开辟了新道路,也为多种应用铺平了道路。
西湖大学生命科学学院卢培龙研究员和清华大学化学系刘磊教授为论文共同通讯作者。西湖大学生命科学学院博士研究生孙科、博士后李思聪、博士后郑博闻、博士后朱雁磊以及清华大学化学系博士研究生王通越为本文的共同第一作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


