重大突破!Nature:CRISPR - Cas9 除基因编辑外,竟还能这样调控细菌免疫
来源:生物谷原创 2025-09-08 10:19
来自密歇根大学等机构的科学家们通过研究揭示了CRISPR-Cas9在细菌免疫中的新角色,从而为理解细菌如何适应环境变化提供了新的视角。
在生物技术领域,CRISPR-Cas9 早已是家喻户晓的 “基因剪刀”——从遗传病治疗到作物育种,它的应用几乎贯穿整个生命科学研究。但很少有人知道,这个强大工具在细菌自己的 “免疫战场” 上,还藏着一套鲜为人知的 “调节技能”。
近日,密歇根大学团队在《Nature》发表重磅研究,首次揭示:CRISPR-Cas9 中的Cas9 蛋白,除了作为 RNA 引导的核酸酶切割 DNA,还能在没有crRNA(CRISPR RNA) 和tracrRNA(反式激活 CRISPR RNA) 陪伴时,像 “免疫哨兵” 一样感知细胞内 crRNA 的水平,动态调节细菌的 “免疫记忆” 深度——当记忆库空虚时加速补充,当记忆充足时及时 “刹车”,既帮细菌对抗病毒,又避免误伤自身。

细菌和病毒的 “军备竞赛” 从未停歇,而 CRISPR-Cas 系统是细菌最核心的 “免疫武器”:它会将入侵病毒的 DNA 片段(称为 “间隔序列”)整合到自身基因组的 CRISPR 数组中,形成 “免疫记忆”;后续再遇到同种病毒时,数组转录出的 crRNA 会引导 Cas9 精准切割病毒 DNA。据估计,全球约 50% 的细菌都携带 CRISPR-Cas 系统,在某些环境中这一比例甚至更高——足以见得它对细菌生存的重要性。但长期以来,科学家们只知道 Cas9 需要 crRNA/tracrRNA 才能发挥切割作用,却不清楚当这两种 RNA 缺失时,Cas9 是否还有其他功能,更不知道它如何调控 “免疫记忆” 的更新节奏。
为解开这个谜题,研究团队以脑膜炎奈瑟菌(Neisseria meningitidis) 为研究模型——这种细菌携带 II-C 型 CRISPR-Cas 系统,且容易被MDAΦ 噬菌体感染(该噬菌体不会裂解细菌,但会整合到宿主基因组影响致病性)。
他们通过基因编辑构建了多种突变菌株:比如R26 菌株(仅保留 CRISPR 数组的一个重复序列,无法产生成熟 crRNA,相当于 “crRNA 缺失型”)、Δtracr 菌株(缺失 tracrRNA),以及 Cas9 结构突变体(如Cas9H1024A,破坏其 PAM 结合位点,无法识别病毒 DNA 的 PAM 序列)。同时,他们用转录组测序、Northern blot(检测 crRNA/tracrRNA 水平)、Western blot(验证 Cas9 蛋白表达)和高通量测序(分析新获取的间隔序列)等技术,全面追踪 Cas9 的功能。
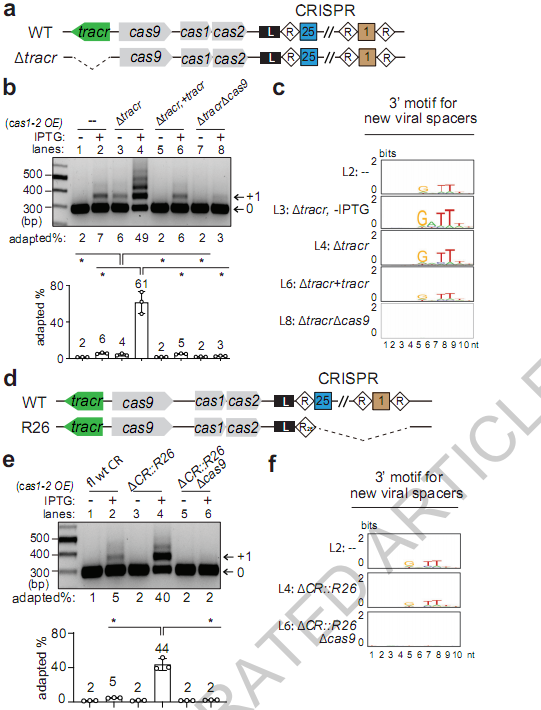
超适应表型是由Δtracr或缺乏crRNA引起的
实验结果首先揭示了一个关键现象:当 crRNA 或 tracrRNA 缺失时,细菌会出现 “超适应(super-adaptation)” 表型——间隔序列的获取效率大幅提升。比如,在 Cas1-Cas2(负责整合间隔序列的酶)过表达条件下,正常菌株的间隔序列获取效率仅 6%,而 Δtracr 菌株直接飙升到 61%,甚至能同时获取 2-4 个新间隔序列;R26 菌株的获取效率也从 5% 提升到 44%。更重要的是,这种超适应完全依赖 Cas9——如果敲除 cas9,Δtracr 或 R26 菌株的获取效率会骤降到 2-3%,且新间隔序列不再有正确的 PAM(3’-N4GATT),证明是apoCas9(无 RNA 结合的 Cas9) 在驱动这一过程。
深入研究发现,Cas9 的 “调节技能” 核心是 “感知 crRNA 水平”:当细菌的 CRISPR 数组较短(比如仅 1 个重复序列)时,crRNA 产量极低,大量 Cas9 以 apoCas9 形式存在,它们会促进 Cas1-Cas2 整合新的病毒间隔序列,快速扩展 “免疫记忆库”——此时间隔序列获取效率高达 31%;随着 CRISPR 数组逐渐变长(比如含有 25 个间隔序列),crRNA 水平随之升高,它们会与 Cas9 结合形成复合物,使 apoCas9 减少,从而抑制间隔序列获取,效率降至 4-6%。这种调节能避免细菌过度获取间隔序列——如果无限制获取,可能会误将自身 DNA 当作病毒片段整合,引发 “自身免疫” 风险。
研究团队还在 “自然数组收缩” 的细菌中验证了这一机制:当细菌因基因重组丢失部分间隔序列(比如从 25 个减少到 9 个),crRNA 水平会随之下降,apoCas9 再次增多,间隔序列获取效率从 5% 提升到 9-15%,帮助细菌快速补充丢失的免疫记忆。更令人惊喜的是,这种功能在进化上高度保守——除了空肠弯曲杆菌(Campylobacter jejuni)的 CjeCas9 外,其他多种 II-C 型 Cas9(如流感嗜血杆菌的 HpaCas9、巴氏杆菌的 PmuCas9)都能通过 apoCas9 调节间隔序列获取,且新间隔序列的 PAM 偏好与各自的 CRISPR 系统一致,证明这是细菌普遍具备的 “免疫调节策略”。
这项研究彻底刷新了我们对 CRISPR-Cas9 的认知:它不仅是一把精准的 “基因剪刀”,还是细菌免疫记忆的 “智能调节器”。这一发现不仅填补了 CRISPR 系统 “适应机制” 的空白,还为生物技术应用提供了新方向——比如通过调控 apoCas9 活性,优化 CRISPR-based 分子记录工具(记录细胞内事件),或改造益生菌的 CRISPR 系统,增强其对抗有害病毒的能力。未来,当我们再谈论 CRISPR-Cas9 时,或许会多一个视角:它不仅是人类的科研工具,更是细菌在亿万年进化中锤炼出的 “免疫智慧” 结晶。(生物谷Bioon.com)
参考文献:
Zhou, X., Diao, R., Li, X. et al. Cas9 senses CRISPR RNA abundance to regulate CRISPR spacer acquisition. Nature (2025). doi:10.1038/s41586-025-09577-9
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


