AD:tau病种子,已经有毒!科学家发现,tau蛋白原纤维可以通过改变代谢,诱导血脑屏障功能障碍
来源:奇点糕 2025-04-07 11:08
Tau蛋白异常聚积是神经退行性疾病的典型病理之一,不仅影响神经元功能,也有可能通过代谢重编程和炎症反应导致内皮细胞损伤和脑血管功能障碍。
研究结果表明,原纤维和纤维状tau通过增加糖酵解水平,诱导内皮屏障通透性,使内皮细胞表现促炎表型,连接蛋白表达受损。Tau蛋白异常聚积是神经退行性疾病的典型病理之一,不仅影响神经元功能,也有可能通过代谢重编程和炎症反应导致内皮细胞损伤和脑血管功能障碍。
病理条件下,tau蛋白发生过度磷酸化,失去与微管的结合能力,逐渐聚集形成原纤维结构。原纤维状tau被认为是tau病理扩散的“种子”,通过细胞间传播机制在大脑中扩散。原纤维状tau进一步聚集,形成更稳定、更紧密的纤维状结构,也就是纤维状tau。纤维状tau是高度聚集的“终末产物”,是神经元受损和死亡的晚期病理标志。
来自天普大学阿尔茨海默病中心的研究团队讨论了纤维和原纤维状tau对内皮代谢和血脑屏障的影响。
研究结果表明,原纤维和纤维状tau通过增加糖酵解水平,诱导内皮屏障通透性,使内皮细胞表现促炎表型,连接蛋白表达受损。在携带人类微管相关tau蛋白基因突变的年轻小鼠模型(P301S)中,也发现了糖酵解水平增加和血管病理表型增加。
研究发表在Alzheimer's & Dementia杂志上。

研究人员使用人脑微血管内皮细胞系搭建了体外血脑屏障模型,诱导原纤维状tau聚集之后,测量跨内皮电阻,并进行毒性检测。结果显示,原纤维状tau诱导了剂量依赖性的屏障阻力下降,也就是血脑屏障通透性增加,但是没有发现内皮细胞凋亡或坏死。原纤维状tau的内皮细胞毒性也与tau浓度和暴露时间有关,浓度越高、暴露时间越长,原纤维状tau的毒性越强。
研究人员还在细胞内发现了原纤维状tau。免疫染色结果显示,原纤维状tau处理后,内皮细胞膜内壁出现更多断裂,紧密连接蛋白水平降低,并且分布变得不均匀,紧密连接结构被破坏。

连接蛋白ZO-1受损(剪头表示连接中断)
进一步研究发现,原纤维状tau聚集不仅影响内皮细胞结构,能量代谢也发现显著变化。处理3小时后,内皮细胞的糖酵解水平显著增加,细胞代谢从氧化磷酸化向糖酵解转变,产生了类似瓦博格效应。同时,炎症反应增强,多种促炎细胞因子和粘附分子水平显著上调。
根据以上发现,研究人员推测,tau聚集诱导的糖酵解增加可能导致了内皮细胞炎症反应和血脑屏障功能受损。使用药物抑制糖酵解水平,可以降低促炎因子水平,显著改善屏障功能。
研究人员还用人类阿尔茨海默病患者脑提取物中的纤维状tau对内皮细胞进行刺激,同样发现内皮细胞屏障功能受损、糖酵解水平增加、炎症反应增强,进一步证实了tau聚集体在内皮细胞损伤和血脑屏障功能障碍中的作用。
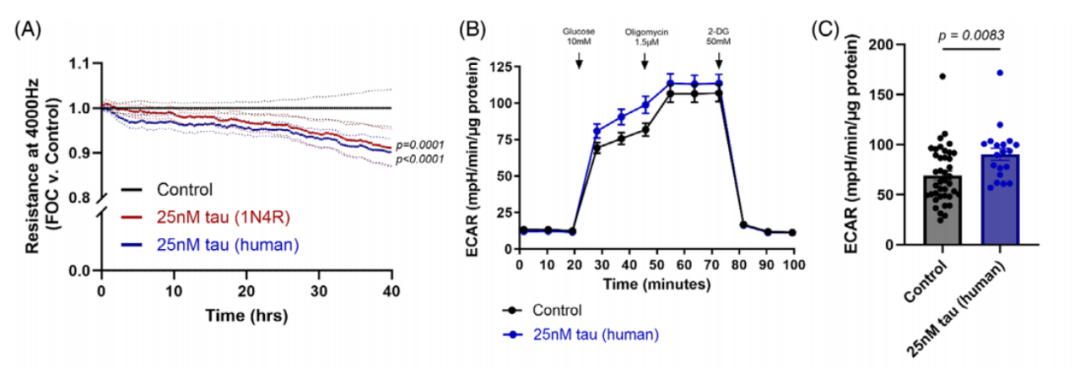
人类来源的纤维状tau诱导糖酵解水平增加
在3月龄P301S小鼠中,tau纤维发生早期积累。染色结果显示,与野生型小鼠对比,P301S小鼠的毛细血管和小动脉上可以观察到更多的tau聚集,维持血脑屏障完整的关键紧密连接结构受损。代谢方面,糖酵解ATP生成增加,线粒体ATP生成减少,内皮细胞促炎细胞因子水平增加。这些都为后续的tau相关病理埋下伏笔。
总的来说,研究揭示了tau介导脑血管功能障碍的新型分子机制和代谢变化,可能在tau相关神经退行性疾病的早期阶段发挥关键作用。血管代谢异常可能可以作为tau蛋白病的早期标志物或干预靶点。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


