STM:为什么有人患癌有人不患癌?黄波团队揭示背后的肿瘤免疫逃逸新机制
来源:生物世界 2023-02-08 10:05
这项研究证明了,肿瘤抗原异质性肿瘤细胞的固有特征,在肿瘤发生极早期就已经存在,由表观遗传改变引起:机械力信号→SMYD3→CSDE1上调→TCPTP上调→STAT1去磷酸化失活→肿瘤干细胞成瘤。
在微观的尺度下,人体就像是一个没有硝烟的战场,除了细菌、病毒这些外来入侵者,还有来己方阵营的“叛徒”——癌细胞。众所周知,癌症是基因突变导致的,但并不意味着只要发生了基因突变就会得癌症,这归功于肿瘤免疫监视的存在。
自20世纪50年代末免疫监视理论提出以来,免疫系统在限制肿瘤发生中的作用已被广泛接受。这一理论的核心是肿瘤细胞由于基因突变而产生了非自身抗原,从而引发免疫反应,因此,免疫系统可以在临床表型出现之前不断识别和清除这些癌前细胞。
然而,这一理论无法解释为什么肿瘤仍然能够在免疫系统功能健全的人身上发生发展,也就是这些肿瘤为何会从免疫监视中逃逸。
癌症免疫编辑理论则认为,免疫系统和肿瘤细胞之间的相互作用是一个动态过程,不仅涉及肿瘤预防,而且还塑造了发展中的肿瘤的免疫原性。具体来说,识别肿瘤抗原的T细胞介导免疫清除的过程中,免疫系统通过影响肿瘤微环境或者引起肿瘤细胞自身改变,诱导形成了免疫原性较低的肿瘤细胞亚群。低免疫原性的肿瘤细胞是导致免疫监测和免疫治疗最终失败的根本原因。
尽管这一理论为肿瘤免疫逃逸提供了有说服力的解释,但关于早期或原始致瘤细胞发生免疫逃逸的原因仍然不清楚。例如,在免疫系统施加选择性压力之前,早期致瘤细胞在肿瘤抗原表达上是否具有内在异质性?是什么机制决定和调控它们的抗原表达水平?
2022年2月3日,中国医学科学院基础医学研究所黄波教授团队(助理研究员吕家迪和博士后周雅博为论文共同第一作者)在 Science 子刊 Science Translational Medicine 上发表了题为:Epigenetic modification of CSDE1 locus dictates immune recognition of nascent tumorigenic cells 的研究论文。
该研究揭示了早期肿瘤干细胞躲避免疫监视的谜团,由此从源头上解释了,为什么有的人不抽烟、不喝酒且生活作息均衡但最终还是患上癌症,而有的人抽烟、喝酒、熬夜却没有患上癌症——他们的体内都会不可避免地出现肿瘤细胞,但只有一小部分肿瘤细胞会能够逃逸肿瘤免疫监视,最终发展为癌症。而这些细胞的不同逃逸肿瘤免疫监视的能力,是由CSDE1基因的差异表观遗传修饰和随后的差异表达所决定的。
该研究揭示了肿瘤免疫逃逸的新机制,对于肿瘤的早期预防和免疫治疗预后具有重要帮助,也为发展下一代肿瘤免疫治疗指明了新的方向。


黄波教授
黄波,北京协和学者特聘教授,中国医学科学院基础医学研究所副所长。国家杰出青年科学基金获得者,教育部“长江学者”特聘教授,国家“百千万工程”领军人才。黄波教授致力于研究肿瘤免疫、肿瘤免疫治疗、生物机械力学、肿瘤休眠、肿瘤代谢等前沿医学科学问题,在肿瘤免疫逃逸、T细胞耗竭及新型肿瘤免疫疗法等领域取得一系列原创性成果。
免疫系统与肿瘤细胞的博弈是高度动态的,即免疫系统在不断识别和清除肿瘤细胞的同时,肿瘤细胞也会通过干预识别进行免疫逃逸。打个比方,免疫系统和癌细胞就像是在玩“捉迷藏”,免疫监视成功与否不仅仅取决于免疫系统的侦察能力,还取决于肿瘤细胞的反侦察能力。
在人体内,DNA突变是时刻发生的,但只有在极少数情况下,DNA突变才会导致正常细胞转化为肿瘤细胞。然而,即便如此,这些肿瘤细胞也不等同于肿瘤,在人群中只有极少数个体的肿瘤细胞最终发展成为有临床症状的肿瘤,即人们常说的“得了肿瘤”。那么,同样是恶性转化的肿瘤细胞,为什么有的会长成肿瘤,而有的有不会长成肿瘤呢?
这些最终会长成肿瘤的极少数的肿瘤细胞,被称为肿瘤干细胞(Cancer stem cells,CSCs),它可以逃避免疫监视而作为肿瘤发生的原始致瘤细胞,是肿瘤发生的根源。遗憾的是,由于长期以来缺乏研究肿瘤干细胞与免疫系统相互作用的代表性的体内外模型,肿瘤干细胞发生免疫逃逸的根本性问题仍未阐述清楚。
在这项最新研究中,黄波团队基于生物机械力学理论建立了软三维纤维蛋白凝胶(Soft 3D fibrin gel)培养系统,并利用此系统在体外筛选、富集并扩增肿瘤干细胞,从而获得由单个肿瘤干细胞生成的肿瘤模型。
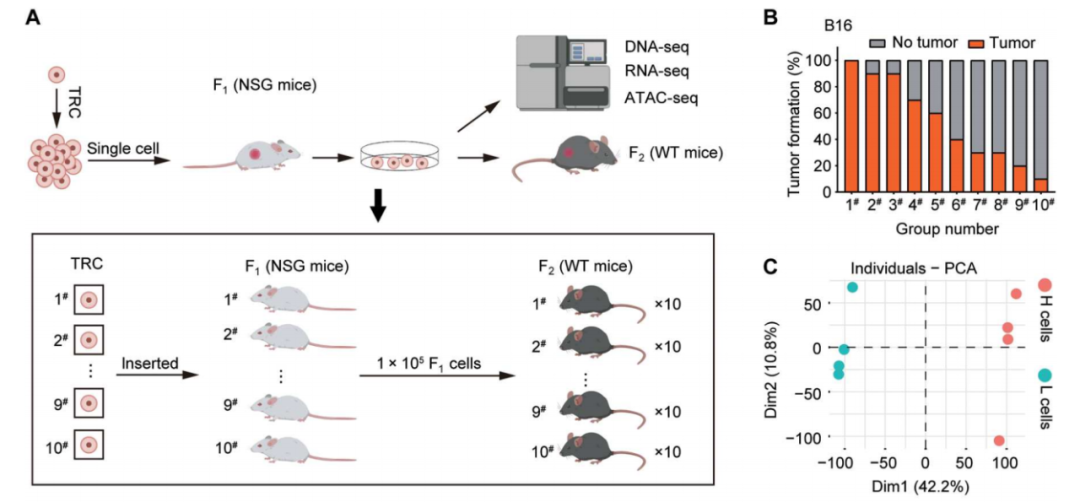
通过3D纤维蛋白凝胶培养系统获得由单个肿瘤干性细胞生成的肿瘤模型
研究团队将这类3D培养细胞称为肿瘤再生细胞(Tumor-repopulating cells,TRCs),并通过TRCs在免疫缺陷或免疫正常的小鼠中形成肿瘤,以此研究肿瘤微环境对肿瘤干细胞的特性的影响。
有趣的是,肿瘤干细胞的形成不仅受到化学信号的影响,而且还受到生物机械力信号的调控。既往研究也表明,肿瘤微环境中生物机械力在调控肿瘤干细胞的形成及维持其干性方面起着至关重要的作用,但尚未清楚其对免疫逃逸有何影响。
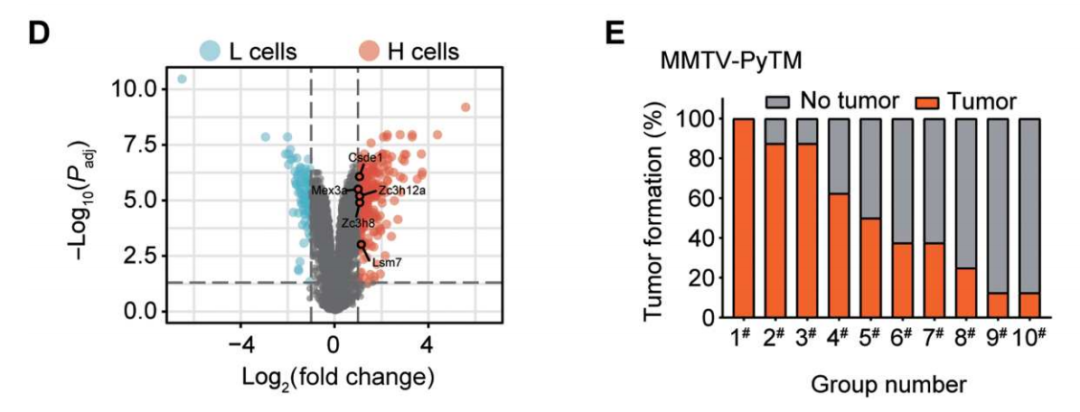
不同的肿瘤干性细胞具有不同的免疫逃逸能力
黄波团队发现,肿瘤微环境的生物机械力影响了TRCs中一种名为CSDE1的基因的表达,并显示出干扰素反应性下降及抗原呈递功能减弱的特性。此外,敲除CSDE1的肿瘤干性细胞只能在免疫缺陷小鼠体内成瘤,而无法在免疫正常小鼠中成瘤。这意味着CSDE1很可能在肿瘤免疫逃逸中发挥着重要作用。
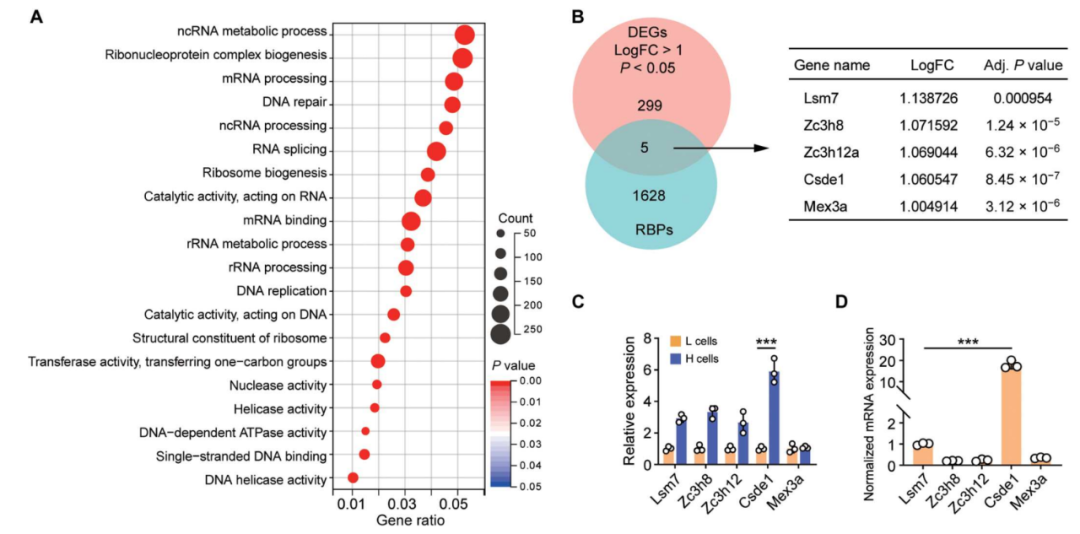
CSDE1调节免疫监视
进一步研究显示,肿瘤微环境的机械力信号通过SMYD3(一种参与癌细胞增殖的组蛋白甲基转移酶)表观遗传修饰调控CSDE1,高表达CSDE1的肿瘤干细胞可以通过稳定T细胞蛋白酪氨酸磷酸酶(TCPTP)的mRNA进而上调其表达量,而TCPTP识别磷酸化的酪氨酸位点,从而使转录激活因子1(STAT1)去磷酸化而失活。
值得注意的是,活化的STAT1是启动抗肿瘤免疫的关键信号,促进肿瘤细胞高表达肿瘤抗原,增强CD8+T细胞的识别和杀伤作用。因此,一旦STAT1去磷酸化失活,肿瘤干细胞获得了肿瘤免疫逃逸的表型,进而逃避免疫攻击,最终发展成为具有临床症状的肿瘤。
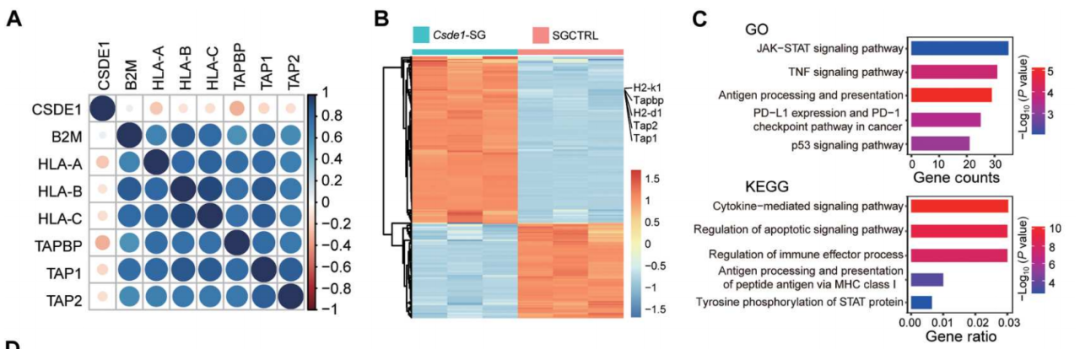
CSDE1通过抑制STAT1的磷酸化来促进逃避免疫识别
总的来说,这项研究证明了,肿瘤抗原异质性肿瘤细胞的固有特征,在肿瘤发生极早期就已经存在,由表观遗传改变引起:机械力信号→SMYD3→CSDE1上调→TCPTP上调→STAT1去磷酸化失活→肿瘤干细胞成瘤。
黄波团队从生物物理力学角度揭示了肿瘤免疫逃逸的新机制,为开发新的肿瘤免疫治疗及生物治疗策略提供理论基础,对于肿瘤的早期预防和免疫治疗预后具有重要作用。
中国医学科学院基础医学研究所助理研究员吕家迪和博士后周雅博为论文共同第一作者,中国医学科学院基础医学研究所黄波教授为论文通讯作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


