Nature重磅:“装甲型”CAR-T治疗实体瘤新突破,细胞因子精准“爆破”且全身毒性归零
来源:生物世界 2025-09-11 10:38
通过内源性基因调控机制,以肿瘤局部化方式表达促炎细胞因子,将扩大“装甲型” CAR-T 细胞安全表达细胞因子的种类,从而有望克服 CAR-T 细胞治疗实体瘤难题。
细胞因子风暴始终如“达摩克利斯之剑”高悬在肿瘤免疫治疗研究的“头顶”,尤其是在 2023 年全球首例 IL-12 装甲 CAR-T 细胞疗法患者死亡事件之后。
而最近,国际顶尖学术期刊 Nature 期刊发表了一篇题为:Rewiring endogenous genes in CAR T cells for tumour-restricted payload delivery 的研究论文,开创性研发出了内源性基因启动子控制细胞因子表达的新方法,在增强 CAR-T 细胞抗肿瘤疗效的同时,减轻细胞因子表达通常伴随的全身毒性。
研究人员筛选出了 NR4A2 和 RGS16 两个天然启动子,分别特异性启动 IL-12 和 IL-2 肿瘤部位的表达,首次实现细胞因子在肿瘤微环境中的“精准爆破”,将 IL-12 全身毒性归零,同时将晚期实体瘤小鼠的存活率从 40% 提升到 100%,显著增强 CAR-T 细胞抗肿瘤效果,从而为安全、有效的 CAR-T 细胞治疗实体瘤提供了突破性解决方案。

CAR-T 细胞疗法已在血液类恶性肿瘤治疗中取得令人瞩目的成果,但在实体瘤领域却屡屡受挫,受制于肿瘤免疫抑制微环境、抗原异质性、CAR-T 细胞持续性低等因素。实体瘤微环境会造成免疫检查点(如 PD-1、CTLA-4)过度表达和抑制性细胞因子(IL-10、TGF-β)富集,此外物理屏障和化学屏障也会严重限制 CAR-T 细胞的浸润和存活。
为了攻克这些挑战,科研人员不断的升级改造 CAR-T 细胞。例如加入不同的共刺激信号结构域 CD28 或 4-1BB,解决 CAR 体内存活时间短、活性差的问题。在第三代 CAR 中同时加入两个共刺激分子,可分泌更多的细胞因子。
为了更好的靶向肿瘤微环境,研究人员开发了第四代 CAR-T——“装甲型” T 细胞(Armored T cell)。
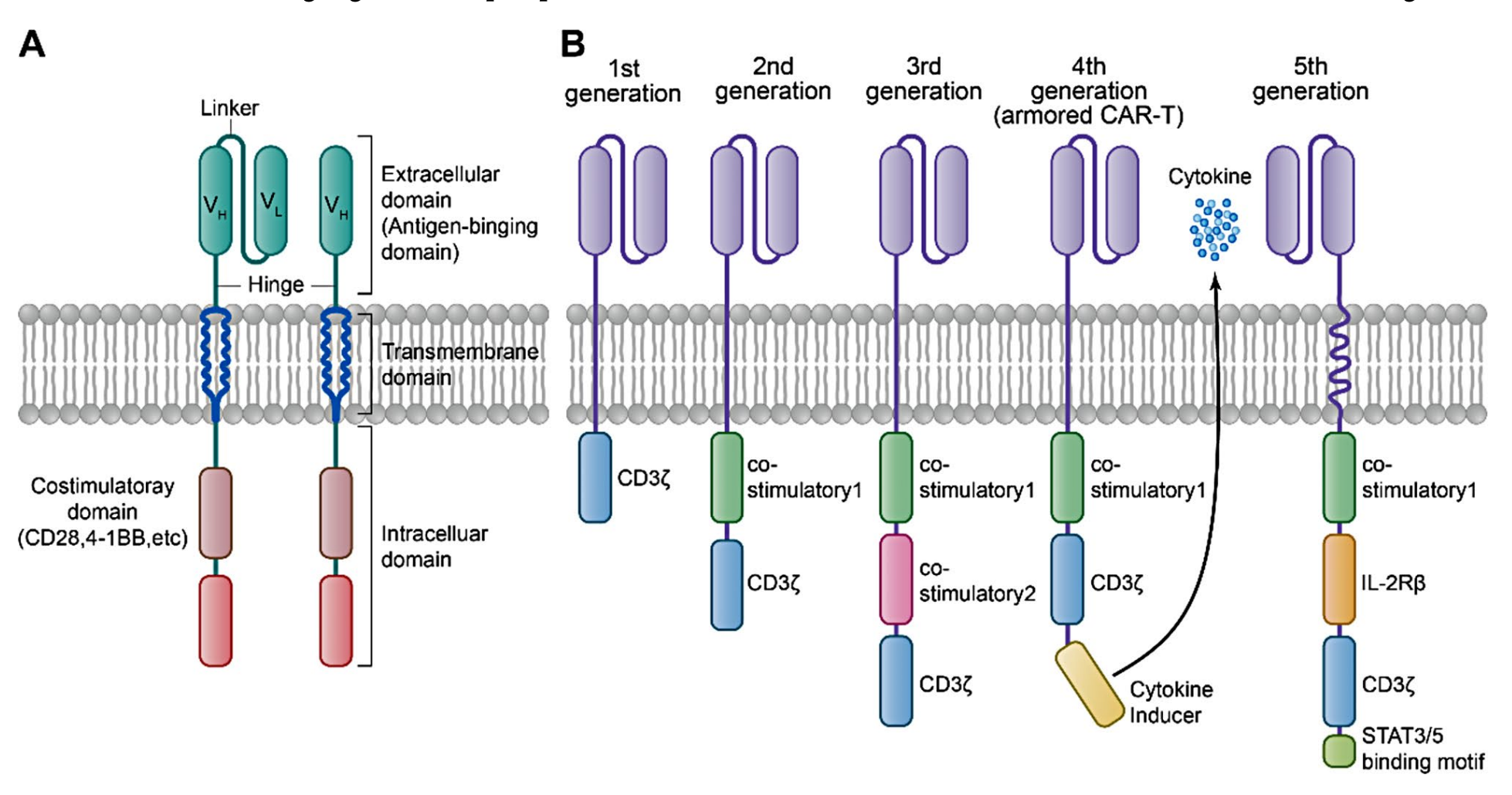
CAR-T 的结构及发展,参考文献2
“装甲型” CAR-T 主要有重定向通用细胞因子杀伤 CAR-T、细胞因子调节 CAR-T 和抗体分泌型 CAR-T 三种类型。装甲 CAR-T 细胞通过释放或调节 IL-12、IL15、IL-18 等细胞因子,或将分泌的抗体直接递送到肿瘤部位,因此,具有促进细胞浸润、抵抗肿瘤微环境的免疫抑制、改善持久性等优势,在增强抗肿瘤作用的同时降低相关毒性。
多项开创性研究显示,IL-2、IL-12、IL-15、IL-18、Flt3L、IFNγ、IL-7 等细胞因子“武装”的 T 细胞在实体瘤治疗上有巨大潜力。然而促炎细胞因子的外周表达可能会导致毒性,是开发装甲 CAR-T 细胞不可忽略的问题。
研究人员已开发多种策略以限制装甲基因仅在肿瘤部位表达,例如 NFAT 诱导型启动子、合成 Notch 系统。但这些策略仅限于短片段调控 DNA,无法实现精准且位点特异性基因表达的调控。因此造成了 NFAT-IL-12 装甲 CAR-T 细胞在临床试验中出现严重毒性的悲剧。
而在这篇 Nature 论文中,研究团队利用 CRISPR 基因编辑技术通过同源定向修复(HDR)将转基因敲入特定基因位点,例如将 IL-12 敲入 NR4A2 或 RGS16 启动子位点,均可引发显著的治疗响应,提高小鼠的长期存活率,且未出现任何明显的毒性作用。此外,治愈后的小鼠表现出对继发性肿瘤的持久免疫力,表明这些“装甲型” CAR-T 细胞不仅能够清除已有肿瘤,还能形成持久的免疫记忆以预防肿瘤复发。
总的来说,通过内源性基因调控机制,以肿瘤局部化方式表达促炎细胞因子,将扩大“装甲型” CAR-T 细胞安全表达细胞因子的种类,从而有望克服 CAR-T 细胞治疗实体瘤难题。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


