《细胞·代谢》:南方医院团队发现,烟酰胺还是胃癌免疫治疗的必争之地!
来源:奇点糕 2024-06-23 15:02
研究团队在接受免疫治疗的胃癌患者队列中证实,以LC-MS/MS质谱分析法测出的患者外周血NAM/MNAM比值,可作为预测患者治疗应答和预后的生物标志物。
南方医科大学南方医院石敏、廖旺军团队发表在Cell Metabolism期刊的最新研究成果揭示,胃癌免疫微环境中存在围绕烟酰胺(Nicotinamide,NAM)的代谢“对峙”(Face-off),巨噬细胞和肿瘤相关成纤维细胞(CAFs)是对峙的双方,巨噬细胞占上风就意味着微环境偏向“免疫炎症型”,而CAFs势大就会把微环境导向不利的免疫抑制状态。
之所以会有这种对峙,是因为巨噬细胞和CAFs分别特异性表达烟酰胺代谢中的限速酶NAMPT和NNMT,表达NNMT的CAFs会分泌NAM主要代谢产物甲基烟酰胺(MNAM),显著抑制CD8+T细胞的抗肿瘤活性,而巨噬细胞能分泌含有NAMPT的细胞外囊泡(EVs),以此抑制CAFs的NOTCH信号通路转导和NNMT表达,助力恢复CD8+T细胞功能;这样区分出敌我之后,未来就可以尝试通过干预烟酰胺代谢增敏胃癌免疫治疗了[1]。
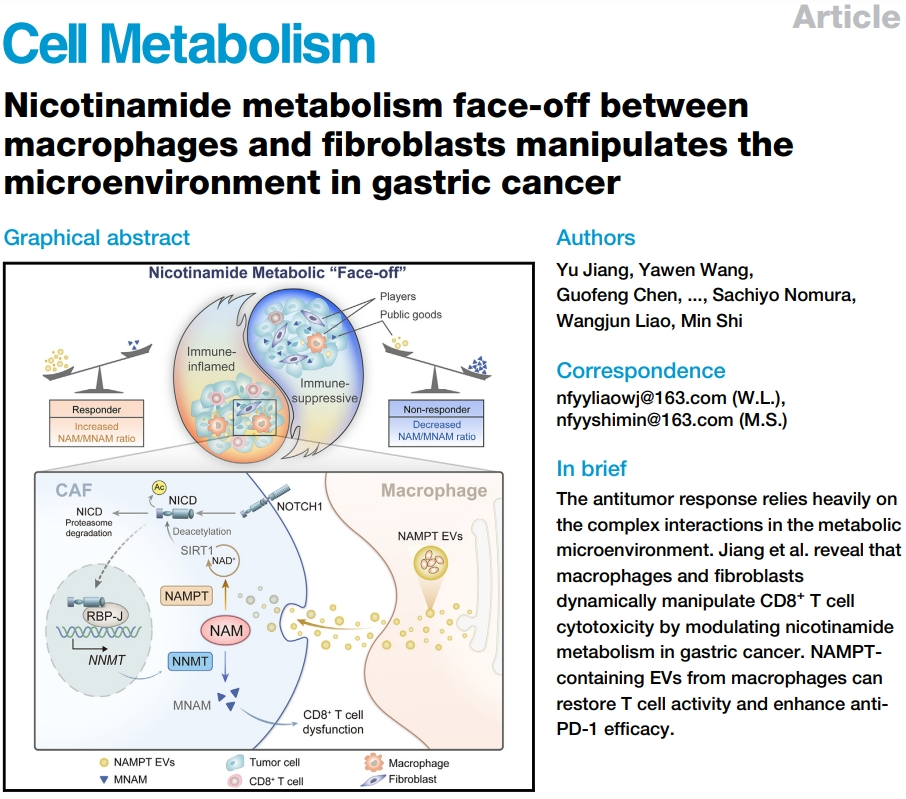
论文核心内容总结
其实南方医院研究团队一开始的探索方向,是筛选与胃癌患者预后存在相关性的代谢物,由此寻找影响免疫治疗的突破口,但没想到一找就是一对:某些属于同一条代谢通路的代谢物,对预后的意义却是相反的,其中“免疫相关性”分数最高的就是NAM和MNAM,NAM与患者预后较好有关,MNAM正好相反,与此前在其它癌症中的一些研究[2-3]结论相符。
研究团队进一步在接受免疫治疗的胃癌患者队列中证实,以LC-MS/MS质谱分析法测出的患者外周血NAM/MNAM比值,可作为预测患者治疗应答和预后的生物标志物,如达到部分缓解患者的该比值较疾病进展患者显著更高(14.51 vs. 7.44, p<0.05),NAM/MNAM比值也与患者无进展生存期(PFS)相关,且在肺癌和食管癌中也有预测价值。
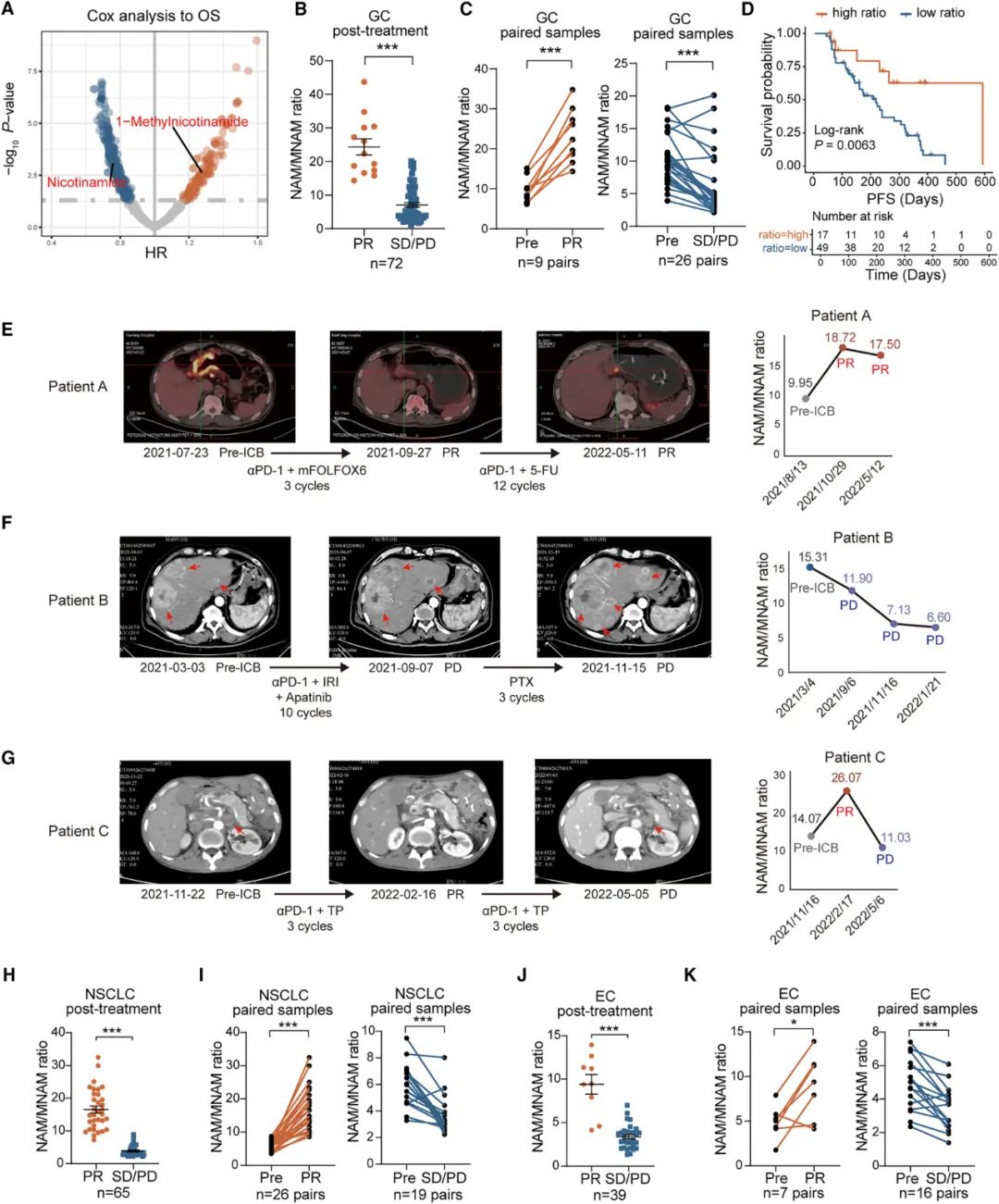
NAM和MNAM这对代谢物与胃癌免疫治疗的关系
发现了现象,接下来就是明确成因,研究团队随即开始顺着烟酰胺代谢通路探索,发现通路中的NAMPT和NNMT两种限速酶,也对患者预后的意义相反,和NAM/MNAM的情况一样,而且两种酶的表达分布也截然相反,表达NAMPT的主要是浸润到应答患者肿瘤内的M1型肿瘤相关巨噬细胞,NNMT表达则基本仅见于不应答患者肿瘤中的促癌性CAFs。
把NAMPT+巨噬细胞和NNMT+CAFs分离出来,进行双向共培养实验的结果则显示,如果只让两种细胞“单挑”,那巨噬细胞更容易占据上风,能够有效抑制CAFs的NNMT表达水平,而巨噬细胞的这种影响依赖于含有NAMPT的EVs,在细胞和小鼠实验中,补充含有NAMPT的巨噬细胞来源EVs,都能有效逆转免疫抑制性微环境。
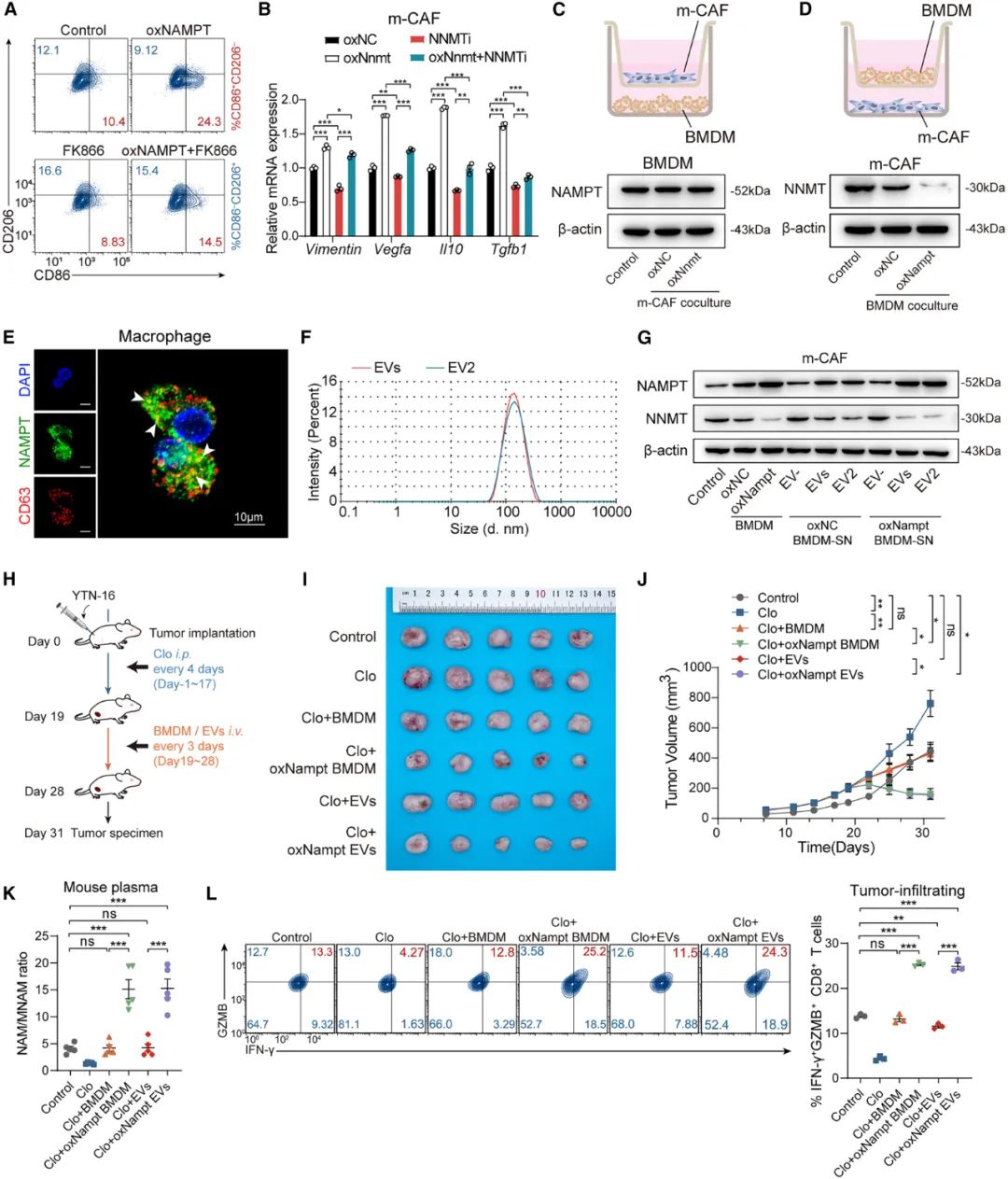
巨噬细胞依靠含有NAMPT的EVs来压制CAFs
接下来研究者们证实,“陷入”巨噬细胞和CAFs双方对峙之中的就是CD8+T细胞:NAMPT+巨噬细胞和NNMT+CAFs的数量比,会直接影响CD8+T细胞功能,其中NNMT+CAFs分泌的MNAM,会通过抑制IκB和NF-κB-p65磷酸化,干预NF-κB激活以抑制CD8+T细胞活性,但补充含有NAMPT的巨噬细胞来源EVs,就能挽救CD8+T细胞。
同时,含有NAMPT的巨噬细胞来源EVs压制CAFs的机制也明确了:这些EVs被CAFs内吞后,会有效抑制CAFs内的组蛋白脱乙酰酶SIRT1活性,这会使NOTCH配体胞内段(NICD)发生去乙酰化,降低蛋白稳定性和表达水平,从而使NOTCH通路激活水平下降;而NOTCH通路中的转录因子RBP-J,恰恰是与NNMT基因启动子结合并激活其转录,使CAFs能抑制CD8+T细胞功能的关键点,所以巨噬细胞也是精准地打到了“七寸”上。
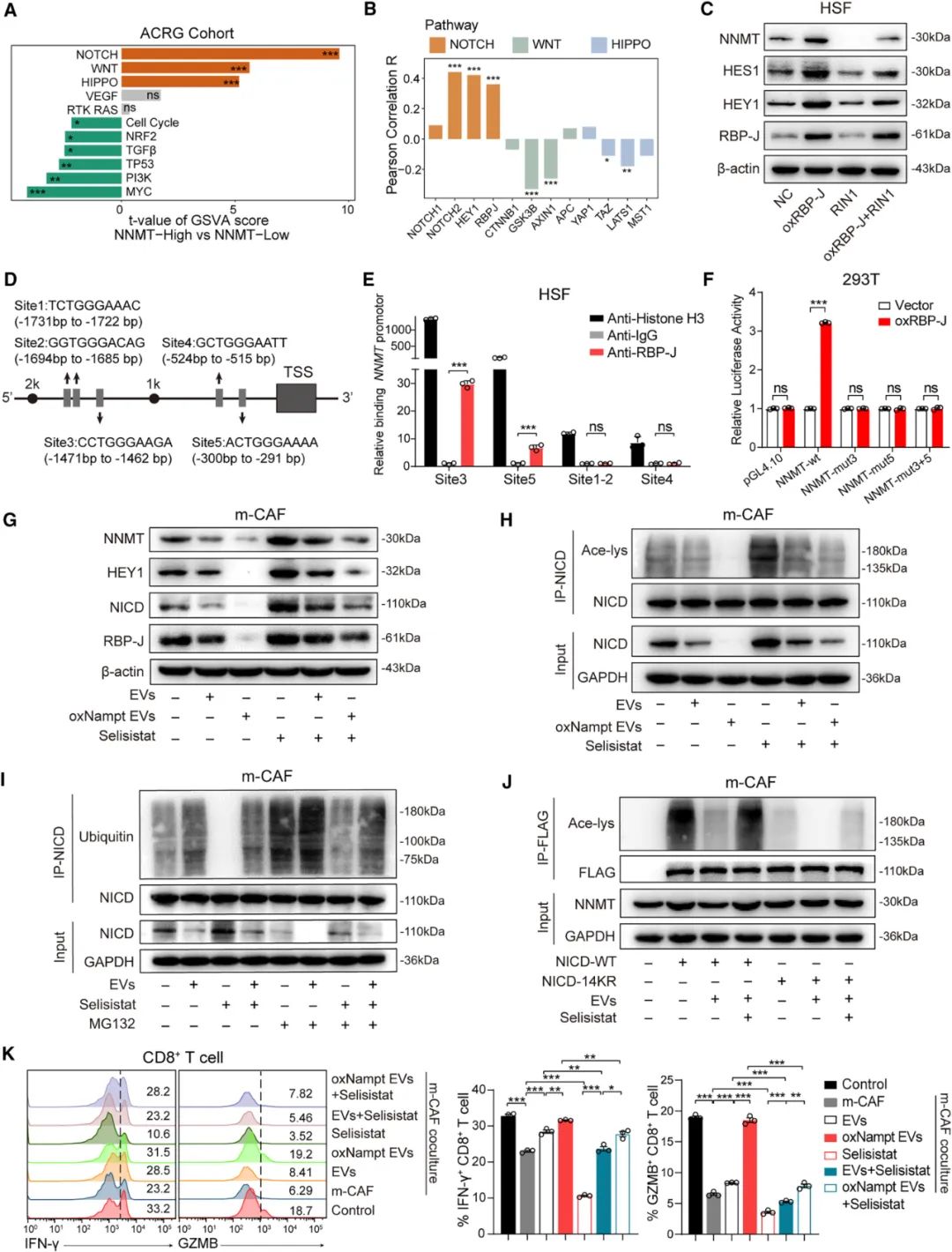
含有NAMPT的巨噬细胞来源EVs抑制CAFs内NNMT表达的机制
总而言之,帮巨噬细胞占到对峙中的上风,就是帮了CD8+T细胞和胃癌免疫治疗,那下一步的探索方向就很明确了,想办法搞出效果不亚于细胞外囊泡的人造药物,就能让CD8+T细胞们重新昂首挺胸,赶紧去救死扶伤了。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


