研究发现饥饿诱导酮体生成的新型调控机制
来源:上海营养与健康研究所 2021-10-20 20:26
近日,Molecular Metabolism在线发表了中国科学院上海营养与健康研究所陈雁研究组题为PAQR9 regulates hepatic ketogenesis and fatty acid oxidation during fasting by modulating protein stability of PPARα的研
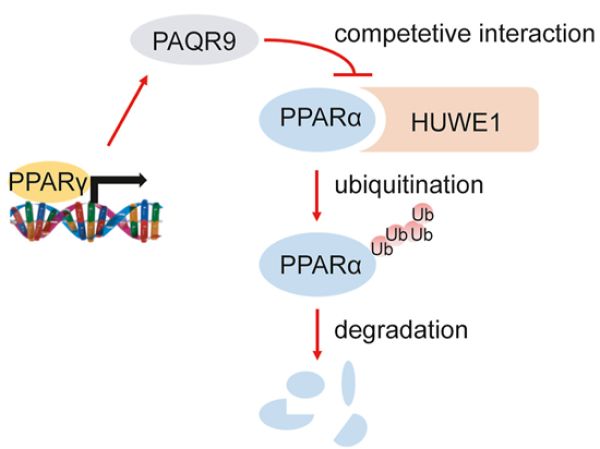
近日,Molecular Metabolism在线发表了中国科学院上海营养与健康研究所陈雁研究组题为PAQR9 regulates hepatic ketogenesis and fatty acid oxidation during fasting by modulating protein stability of PPARα的研究论文。 该研究首次发现内质网蛋白PAQR9能通过调节肝脏细胞的转录因子PPARα的稳定性,参与饥饿诱导肝脏酮体生成和脂肪酸氧化。
饥饿和进食的交替是生命根本的生理过程,其中可发生大量代谢状态变化。肝脏是体内重要的代谢器官,在饥饿的过程中会响应营养缺乏信号,进行脂肪酸氧化和酮体生成,为机体提供能量。该过程会受转录因子调控,其中PPARα是核心转录因子,PPARα基因缺失会导致饥饿过程中脂肪酸氧化降低。研究组前期研究已发现,PPARα会通过E3泛素连接酶HUWE1的泛素化修饰介导蛋白酶体途径降解。
近期,研究组博士研究生林毅君等通过大数据分析和动物实验发现,在饥饿状态下的肝脏中,PAQR9是下调最显着的基因之一,并鉴定出饥饿-进食过程中PAQR9的表达受到PPARγ的直接调控。通过对PAQR9基因敲除小鼠进行一系列代谢表征研究,发现敲除PAQR9不影响小鼠正常进食情况下的代谢状态,但会显着降低小鼠饥饿情况下肝脏的酮体生成和脂肪酸氧化能力。分子机制研究发现,敲除小鼠肝脏中的PPARα,转录水平不会受到影响,但蛋白含量显着下降。细胞实验证实,PAQR9能够降低PPARα泛素化导致的降解。进一步研究PAQR9对PPARα泛素化水平的调控机制,发现PAQR9能够和介导PPARα降解的HUWE1竞争性结合以保护PPARα不被降解。体外HUWE1敲除和体内PPARα激动剂回补实验均充分验证了PAQR9竞争性结合HUWE1保护PPARα蛋白稳定性模型的可靠性。综上所述,该研究揭示出内质网蛋白PAQR9能够通过泛素化调控转录因子PPARα的活性,揭示出一个新的肝脏脂代谢调控机制。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


