Cancer Immunol Immunother:当“别吃我”信号遇上“肿瘤GPS”——双功能抗体精准狙击实体瘤,让免疫细胞精准吃掉癌细胞!
来源:生物谷原创 2025-06-10 14:08
本研究构建了SIRPα-αMSLN局部抑制性检查点单克隆抗体,其能特异性结合间皮素阳性肿瘤细胞,阻断CD47-SIRPα轴,诱导NK细胞介导的细胞毒性和吞噬作用,可用于治疗实体瘤且避免脱靶毒性。
在癌症治疗领域,免疫疗法的出现彻底改变了肿瘤治疗的格局,尤其是单克隆抗体靶向免疫检查点的策略,已成为多种癌症的重要治疗手段。然而,对于上皮性卵巢癌(EOC)、胰腺导管腺癌(PDAC)等实体瘤,传统的适应性免疫检查点抑制剂(ICIs)响应有限,患者预后仍不理想,迫切需要新的治疗方案。
近日,Cancer Immunol Immunother发表了一项重要研究Targeted CD47 checkpoint blockade using a mesothelin-directed antibody construct for enhanced solid tumor-specific immunotherapy,报道了一种靶向CD47与间皮素(MSLN)的双功能抗体构建体——SIRPα-αMSLN局部抑制性检查点单克隆抗体(LicMAb),为实体瘤的免疫治疗提供了新方向。

一、研究背景
CD47作为一种“自我标记”分子,广泛表达于人体几乎所有细胞表面,通过与吞噬细胞上的信号调节蛋白α(SIRPα)结合,传递“别吃我”信号,维持机体免疫稳态。然而,许多肿瘤(尤其是血液肿瘤和实体瘤)会过度表达CD47,借此逃避免疫监视。尽管靶向CD47的单克隆抗体(如magrolimab)在血液肿瘤中展现出抗肿瘤活性,但CD47在健康细胞的广泛表达导致严重的“脱靶毒性”(如贫血、血小板减少),且高剂量用药需求因“抗原汇”效应进一步限制了临床应用。
间皮素(MSLN)是一种肿瘤相关抗原,在EOC、PDAC和间皮瘤等实体瘤中高度表达,而在正常组织中表达有限,是理想的肿瘤靶向分子。基于此,研究团队设计了一种双功能抗体LicMAb,将低亲和力的SIRPα结构域与抗MSLN IgG1抗体融合,旨在实现肿瘤特异性CD47阻断,同时激活固有免疫效应细胞,避免健康细胞损伤。
二、核心研究结果
1. CD47与MSLN在实体瘤中的高表达验证
通过对癌症基因组图谱(TCGA)的泛癌分析显示,MSLN mRNA在EOC和PDAC中显著富集,其蛋白表达在EOC原发肿瘤细胞和腹水中均呈高阳性。CD47 mRNA在所有评估的癌症中普遍高表达,其中EOC的CD47表达水平最高,蛋白水平在肿瘤组织来源的细胞中尤为显著。基因组分析显示,EOC中MSLN和CD47的扩增频率分别为2%和6%,进一步支持两者作为免疫治疗靶点的潜力。
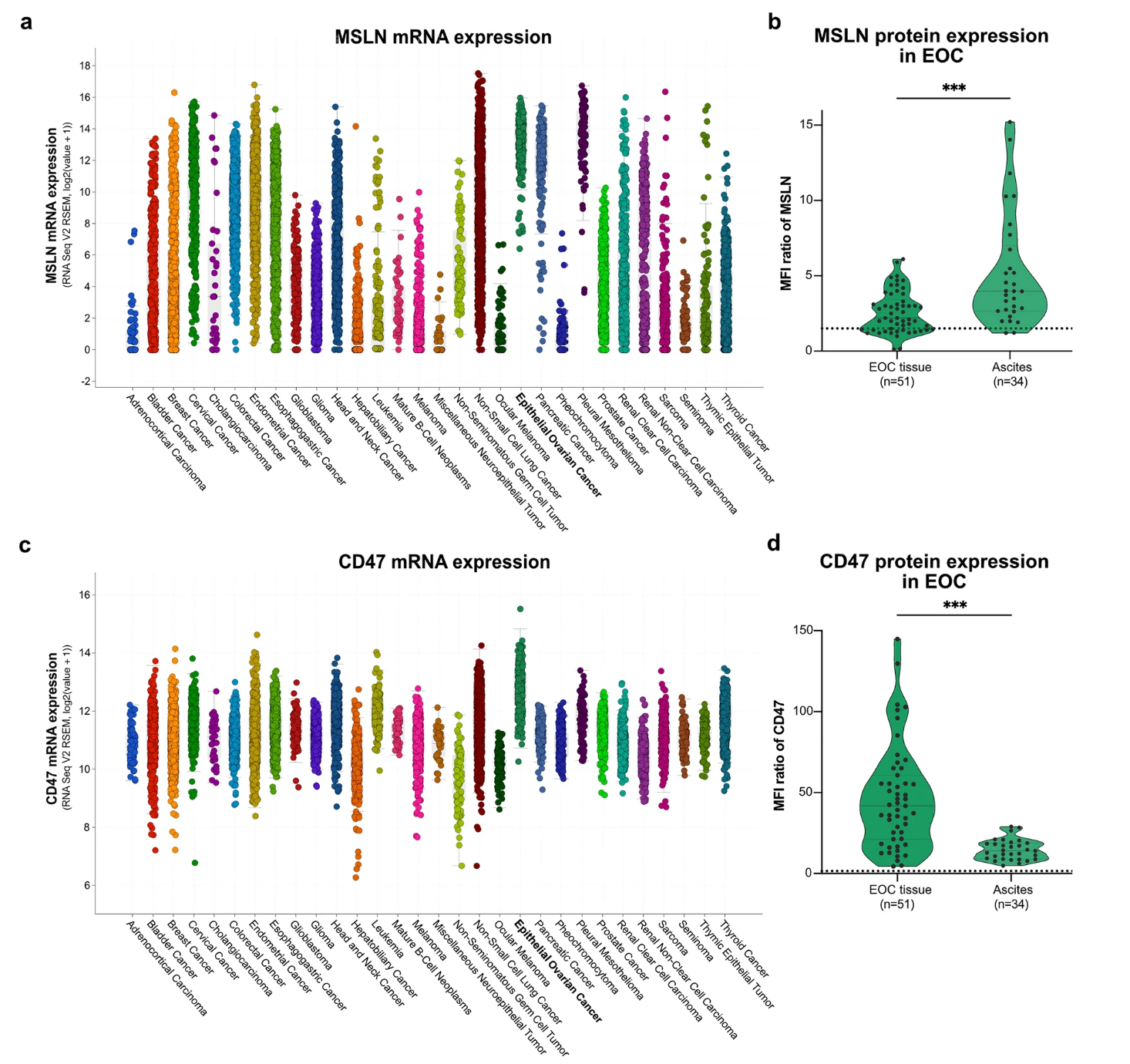
图 1:上皮性卵巢癌(EOC)表现出高MSLN和CD47 mRNA及蛋白水平
2. SIRPα-αMSLN LicMAb的构建与特异性验证
研究团队通过将SIRPα的N端胞外结构域与抗MSLN IgG1抗体的轻链融合,构建了LicMAb。表面等离子体共振(SPR)显示,LicMAb对MSLN的结合亲和力保持在低纳摩尔级别,而对CD47的结合亲和力较低(KD=1 μM),符合SIRPα天然低亲和力特性。流式细胞术证实,LicMAb仅结合MSLN阳性的肿瘤细胞(如EOC细胞系OVCAR-3、PDAC细胞系SUIT2-MSLN及原发EOC细胞),而不结合MSLN阴性的健康细胞(如红细胞、中性粒细胞)。即使在存在高浓度可溶性MSLN(模拟肿瘤微环境中的抗原汇)的情况下,LicMAb仍能维持对肿瘤细胞的结合能力,显著优于传统抗MSLN单克隆抗体。
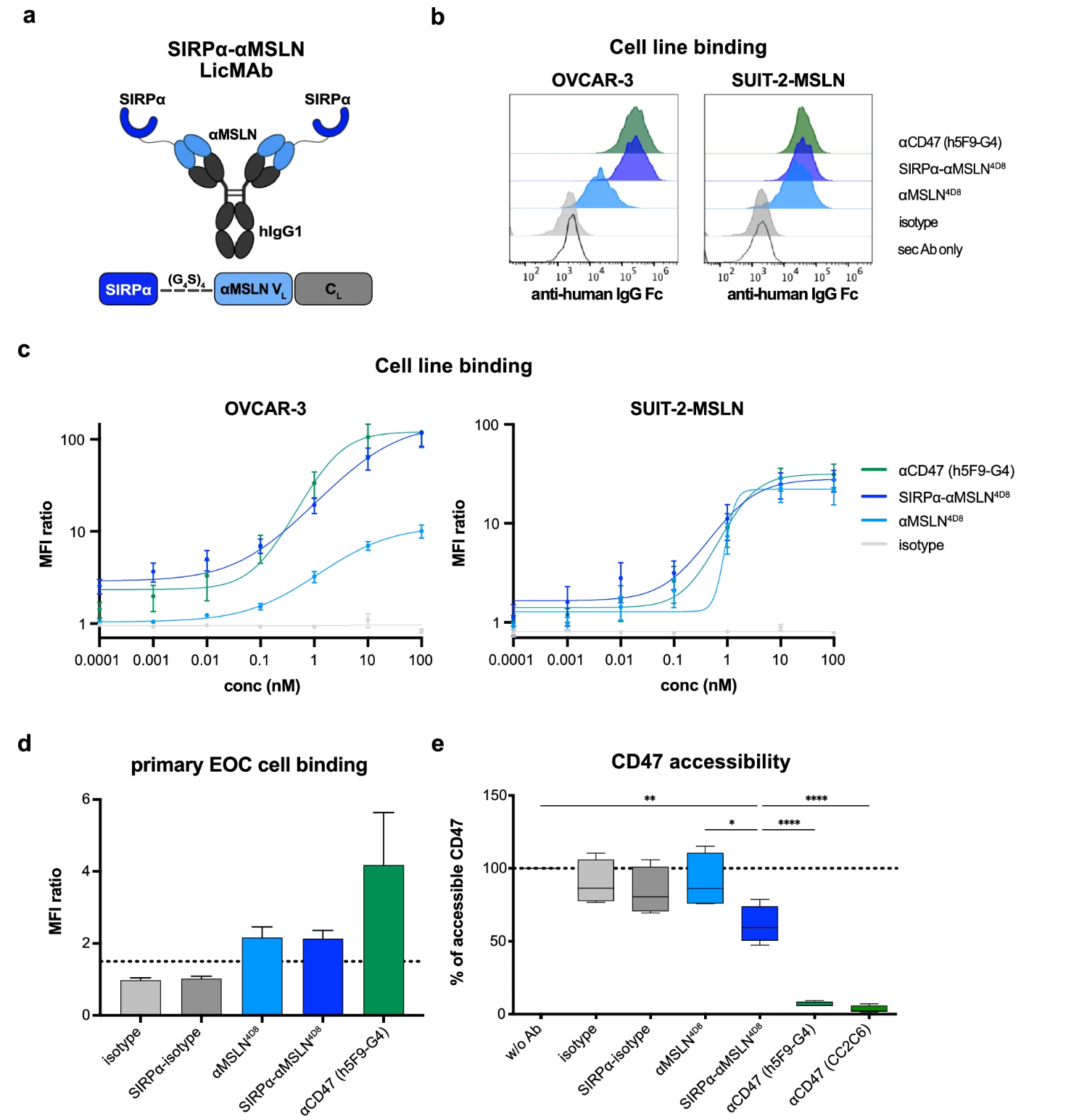
图 2:工程化SIRPα-αMSLN局部抑制性单克隆抗体(LicMAb)具有MSLN特异性靶向和CD47阻断能力
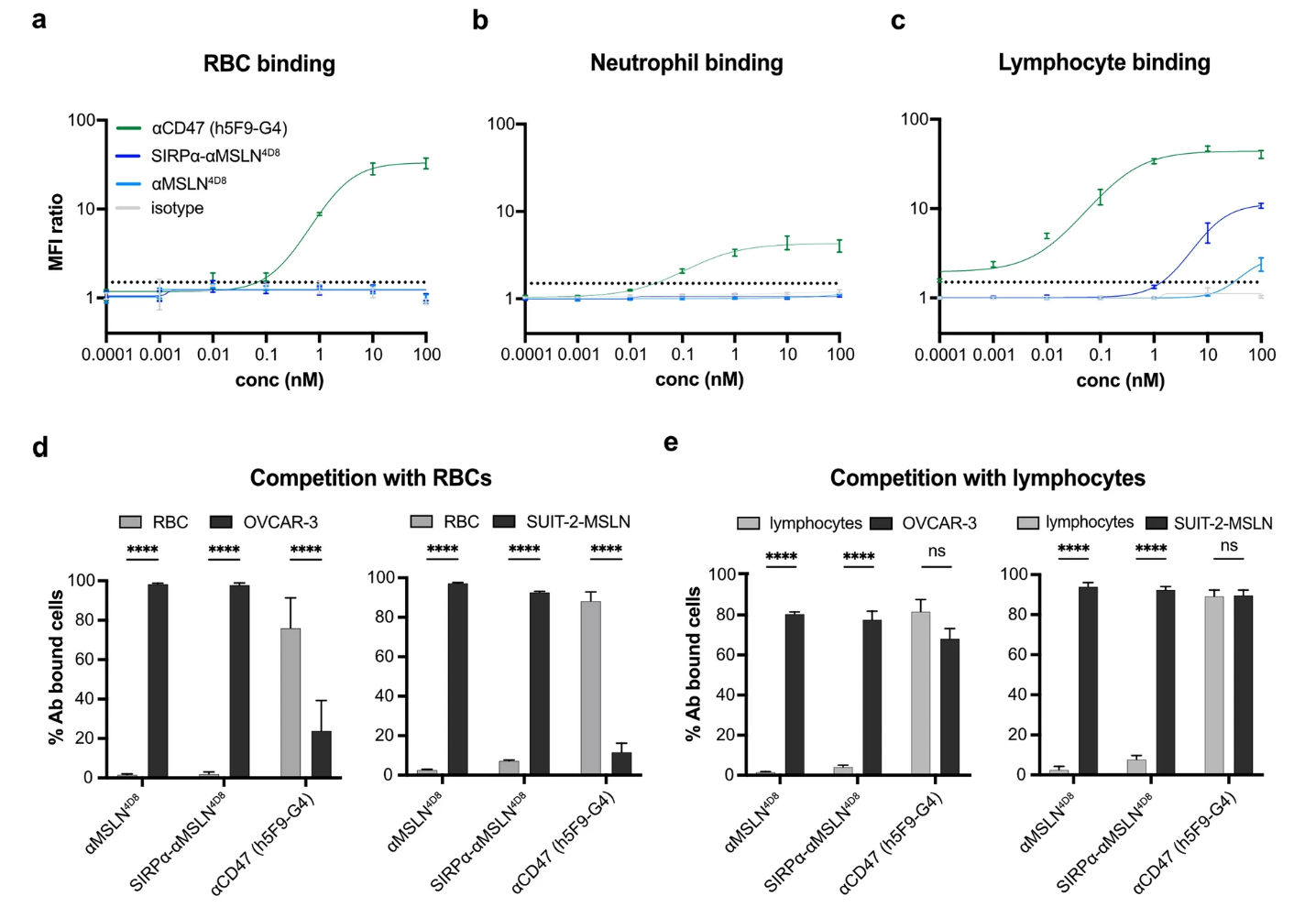
图 3:SIRPα-αMSLN LicMAb避免脱靶结合
3. 强大的抗肿瘤免疫效应:ADCC与ADCP双重机制
抗体依赖性细胞毒性(ADCC):LicMAb通过IgG1的Fc受体激活自然杀伤细胞(NK细胞),诱导肿瘤细胞死亡。在OVCAR-3和SUIT2-MSLN细胞系中,LicMAb介导的ADCC效应显著强于单纯抗MSLN抗体,与高亲和力抗CD47抗体(h5F9-G1)相当,但对健康血细胞无毒性。实时细胞分析显示,LicMAb诱导的NK细胞活化和脱颗粒效应呈剂量依赖性,进一步验证其抗肿瘤活性。
抗体依赖性细胞吞噬(ADCP):LicMAb通过阻断CD47-SIRPα轴并提供IgG1介导的促吞噬信号,显著增强巨噬细胞对肿瘤细胞的吞噬能力。在OVCAR-3细胞中,LicMAb诱导的吞噬率达31.8%,显著高于抗CD47抗体(25.4%)和抗MSLN抗体(15.7%)。在PDAC细胞系中,LicMAb的吞噬诱导能力同样优于双特异性抗体(CD47xMSLN bsAb)。
4. 临床前模型中的有效性验证
在患者来源的EOC类器官(PDOs)模型中,LicMAb联合NK细胞可显著诱导肿瘤细胞死亡,表现为类器官结构崩解和细胞活力显著下降。免疫荧光染色证实,PDOs中MSLN表达均匀且高于原发肿瘤组织,提示LicMAb对肿瘤干细胞样细胞的靶向潜力。与传统药物(如magrolimab)相比,LicMAb在类器官模型中展现出更强的杀伤效力,为临床转化提供了关键证据。
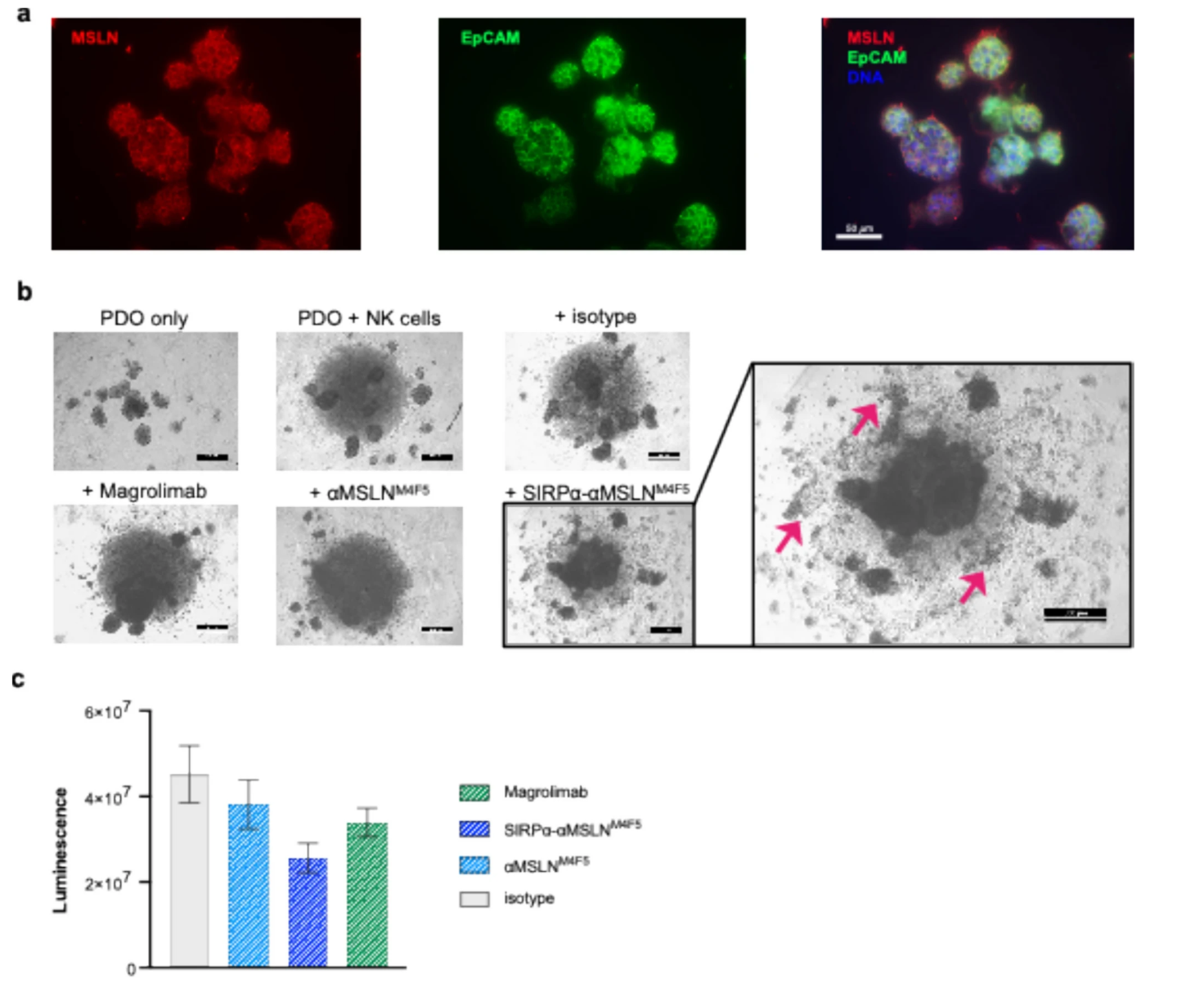
图 4:SIRPα-αMSLN LicMAb诱导EOC类器官的NK细胞介导的细胞毒性
三、总结与展望
这项研究成功开发了一种肿瘤限制性CD47阻断策略,通过双功能抗体LicMAb实现了MSLN阳性实体瘤的精准靶向与免疫激活。其核心优势包括:①利用低亲和力SIRPα结构域避免健康细胞毒性;②通过IgG1-Fc受体同时激活NK细胞和巨噬细胞,诱导ADCC和ADCP双重抗肿瘤效应;③在可溶性抗原存在下仍保持功能活性,克服了传统抗体的抗原汇限制。
尽管目前研究仍处于临床前阶段,但其在多种实体瘤模型中的优异表现,为EOC、PDAC等难治性肿瘤的治疗开辟了新路径。未来,LicMAb与其他免疫疗法(如PD-1抑制剂、STING激动剂)或化疗的联合应用值得进一步探索。随着转化医学的推进,这种兼具安全性与有效性的双功能抗体有望尽早进入临床试验,为实体瘤患者带来新的希望。(生物谷Bioon.com)
参考文献:
Reischer A, Leutbecher A, Hiller B, et al. Targeted CD47 checkpoint blockade using a mesothelin-directed antibody construct for enhanced solid tumor-specific immunotherapy. Cancer Immunol Immunother. 2025;74(7):214. Published 2025 May 22. doi:10.1007/s00262-025-04032-0
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


