Circulation | 南京医科大学季勇/谢利平/王东进发现加重主动脉瘤和夹层的新机理
来源:生物探索 2024-02-25 10:25
该研究证实了在半胱氨酸111 (Cys111)位点Septin2的SNO加重血管紧张素II (Ang II)诱导的主动脉瘤和β-氨基丙腈(BAPN)诱导的主动脉瘤和夹层。
南京医科大学季勇、谢利平及王东进共同通讯在Circulation (IF 38)在线发表题为“S-Nitrosylation of Septin2 Exacerbates Aortic Aneurysm and Dissection by Coupling the TIAM1-RAC1 Axis in Macrophages”的研究论文,该研究表明巨噬细胞中Septin2的S-亚硝基化通过偶联TIAM1-RAC1轴加重主动脉瘤和夹层。在接受主动脉夹层手术的患者和注射血管紧张素II的Apoe-/-小鼠的主动脉组织中,Septin2被鉴定为S-亚硝基化的半胱氨酸111 (Cys111)。SNO-Septin2被证实可促进主动脉瘤和夹层的发展。通过RNA测序,证实巨噬细胞中的SNO-Septin2可加剧主动脉瘤血管炎症和细胞外基质降解。接下来,TIAM1 (T淋巴瘤侵袭和转移诱导蛋白1)被确定为SNO-Septin2的靶蛋白。
机制上,与未修饰的Septin2相比,SNO-Septin2减少了与TIAM1的相互作用,激活了TIAM1- RAC1轴及其相关的核因子-κB信号通路,导致巨噬细胞介导的炎症和细胞外基质降解更强。一致地,R-Ketorolac和NSC23766治疗通过抑制TIAM1-RAC1轴来保护主动脉瘤和夹层。总之,SNO-Septin2通过偶联巨噬细胞中的TIAM1-RAC1轴,激活核因子-κB信号通路依赖性炎症和细胞外基质降解,驱动主动脉瘤和夹层。因此,R-Ketorolac或NSC23766对RAC1的药理学阻断可能是治疗主动脉瘤和夹层的潜在方法。

主动脉瘤和主动脉夹层是高死亡率的心血管疾病。主动脉瘤的特征是主动脉局部或弥漫性扩张,这逐渐增加了急性主动脉夹层的风险。主动脉夹层被定义为内膜破裂,导致主动脉壁层分离,随后形成真腔和假腔。尽管在影像学和血管开放修复和血管内修复方面取得了重大进展,但有效的药物治疗仍然不可用。
巨噬细胞积聚在动脉瘤主壁上,通过影响细胞外基质(ECM)降解和炎症,促进了动脉瘤和夹层的发生研究发现,浸润于主动脉瘤血管壁及夹层的大量巨噬细胞高度表达诱导型一氧化氮(NO)合成酶(iNOS),可催化产生大量NO,并通过蛋白S-亚硝基化(SNO)发挥多种病理生理作用。SNO是将NO部分可逆的共价加成到半胱氨酸硫醇上,形成S-亚硝基蛋白,参与心脏肥厚、心脏纤维化、动脉粥样硬化等多种心血管疾病的发病。因此,SNO可能发生在主动脉瘤及夹层血管组织中iNOS高表达并参与主动脉瘤及夹层的巨噬细胞中。
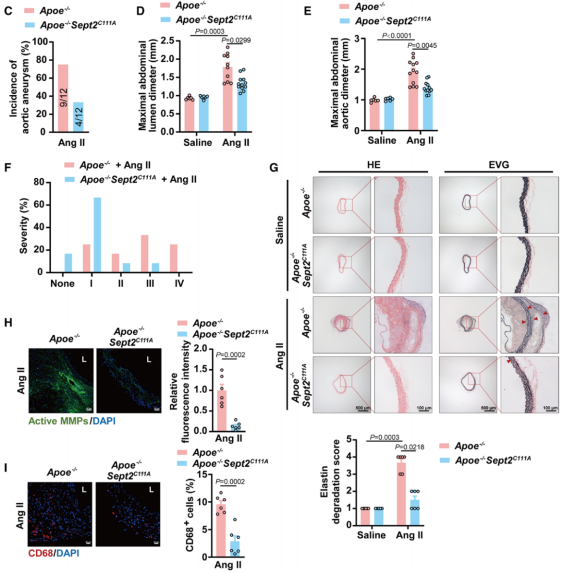
Cys111突变的Septin2减轻主动脉瘤(Credit: Circulation)
Septin2属于Septin家族。Septin是一个高度保守的蛋白家族,在细胞分裂、细胞内物质运输、细胞周期调节和细胞凋亡中被越来越多地认为是细胞骨架的一个新组成部分。已被证明在阿尔茨海默病、癌症、感染和系统性红斑狼疮中发挥重要作用Septin2参与维持内皮细胞连接和内皮完整性。Septin2还可以通过增强内皮细胞的迁移来促进血管生成。然而,Septin2在主动脉瘤和夹层中的作用尚不清楚。
该研究证实了在半胱氨酸111 (Cys111)位点Septin2的SNO加重血管紧张素II (Ang II)诱导的主动脉瘤和β-氨基丙腈(BAPN)诱导的主动脉瘤和夹层。机制上,SNO-Septin2减少其与巨噬细胞中TIAM1 (T淋巴瘤侵袭和转移诱导蛋白1)的相互作用,激活TIAM1RAC1 (Ras相关的C3肉毒毒素底物1)轴及其相关的核因子-κB (NF-κB)信号通路,促进更强的炎症反应和ECM降解。总之,这些发现表明SNO-Septin2可能是动脉瘤和夹层的治疗靶点。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


