Cell:重大进展!靶向TMED9蛋白有往治疗多种毒性蛋白病
来源:本站原创 2019-07-29 12:32
2019年7月29日讯/生物谷BIOON/---科学家们早就知道,数十种称为毒性蛋白病(toxic proteinopathy)的遗传性疾病,是由细胞中特定错误折叠蛋白的堆积引起的。但是,负责这种堆积的分子机制仍然是个谜,这就阻止了开发相应疗法的努力。如今,在一项新的研究中,来自美国布罗德研究所、哈佛医学院和布莱根妇女医院的研究人员发现一些毒性蛋白病可能起源自一个以前未被认识到的原因:细胞运输网络
2019年7月29日讯/生物谷BIOON/---科学家们早就知道,数十种称为毒性蛋白病(toxic proteinopathy)的遗传性疾病,是由细胞中特定错误折叠蛋白的堆积引起的。但是,负责这种堆积的分子机制仍然是个谜,这就阻止了开发相应疗法的努力。
如今,在一项新的研究中,来自美国布罗德研究所、哈佛医学院和布莱根妇女医院的研究人员发现一些毒性蛋白病可能起源自一个以前未被认识到的原因:细胞运输网络(称为分泌途径)中单个特定步骤发生堵塞,其中这种细胞分泌途径要么将蛋白递送至细胞表面,要么将蛋白递送至细胞中的蛋白处理系统之一。相关研究结果发表在2019年7月25日的Cell期刊上,论文标题为“Small Molecule Targets TMED9 and Promotes Lysosomal Degradation to Reverse Proteinopathy”。
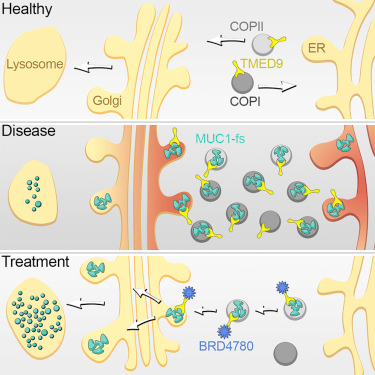
这一发现来自对一种称为MUC1肾病(MUC1 kidney disease, MKD)的罕见疾病的研究,在这种疾病中,这些研究人员发现它起源自肾细胞中MUC1蛋白的错误折叠版本的有害堆积。此外,他们发现肾细胞未能移除这种错误折叠蛋白可追溯到这种细胞分泌途径中的一个特定分子步骤,而且显而易见的是,一种称为BRD4780的化合物能够清除这种堵塞。这种化合物在人肾细胞、肾脏类器官(患者细胞经改造后在培养皿中产生的微型肾脏)和MKD动物模型中起作用。BRD4780可能是开发治疗MKD和其他毒性蛋白病的新药物的起点。不过就目前而言,人们尚没有针对这些毒性蛋白病的治疗方法。
论文通讯作者、哈佛医学院副教授、布罗德研究所肾病计划主任、布莱根妇女医院肾脏专家Anna Greka说道,“我想到的是在研究MKD致病机制的过程中,我们发现了关于细胞如何处理错误折叠蛋白的迷人的新生物学特性,这些关键的新见解可能有助于我们解决几种破坏性疾病。我们的研究团队正在全天候工作,旨在将这些发现转化为我们能够尽快为患者带来的新疗法。”
运输故障
MKD是一种罕见的遗传性疾病,可导致肾功能衰竭。 2013年,由布罗德研究所主席兼创始人Eric Lander、布罗德研究所成员Mark Daly领导的一个研究团队追踪了MKD---之前称为髓质囊性肾病(medullary cystic kidney disease, MCKD)---的遗传根源:基因MUC1上增加了单个碱基。
这种基因突变导致一种截短的错误折叠蛋白(称为MUC1-fs)的产生,这种蛋白便在患者的肾细胞中聚集。随着MUC1-fs的堆积,肾细胞死亡,最终导致肾功能障碍。
为了找到可能有助于从细胞中清除MUC1-fs的药物样化合物(drug-like compound),论文第一作者、布罗德研究所肾病计划博士后研究员Moran Dvela-Levitt、Greka和他们的同事们寻求了布罗德研究所药物再利用中心---一个由3700多种处于不同药物开发阶段的化合物组成的数据库,由布罗德研究所疗法开发中心加以维护----的帮助。通过搜索这个化合物数据库,他们发现了BRD4780,即一种从未进入临床试验且因经证实不能成功作为一种降血压药物而被抛弃的化合物。Greka、Dvela-Levitt和他们的同事们发现BRD4780清除了MUC1-fs,让正常的MUC1保持不变,并阻止发生MKD突变的肾细胞死亡。
当这些研究人员仔细开展研究时,他们惊讶地发现BRD4780并不与MUC1-fs结合。更确切地说,它结合到TMED9上,其中TMED9是一种所谓的“货物受体”,沿着细胞分泌途径携带蛋白货物。
针对人肾细胞、MKD小鼠模型和患者衍生性肾脏类器官的实验显示TMED9捕获MUC1-fs。这使得这种错误折叠的蛋白不会到达溶酶体(一种细胞器,它的作用就是清除不想要的蛋白),从而导致肾细胞中的MUC1-fs升高到危险水平。
这些研究人员指出,当BRD4780与TMED9结合时,TMED9不再捕获MUC1-fs,这就使得细胞降解这种错误折叠蛋白。利用CRISPR敲除编码TMED9的基因也具有相同的效果。
Greka说道,“这是一种全新的生物学。我们并不知道像TMED9这样的货物受体能够阻断并最终干扰错误折叠蛋白的破坏。问题变成了,在其他条件下起作用的相同生物学机制是否是由错误折叠蛋白的堆积引起的?”
并不局限于肾脏
50多种疾病被认为是毒性蛋白病,包括色素性视网膜炎(RP,一种视网膜发生退化的遗传性失明)和UMOD相关肾病(UKD,另一种罕见的遗传性肾病)。Greka和她的同事们推断,细胞分泌途径存在的类似问题可能是这些疾病中至少一些的原因。
在体外实验中,这些研究人员发现BRD4780能够降低RP细胞和UKD细胞中的错误折叠蛋白水平,并增加这些细胞的存活率。Greka和她的同事们估计,类似于BRD4780的药物可能会逆转大约20种疾病,在这些疾病中,错误折叠蛋白在细胞分泌途径中较早地受到阻塞。
Greka说道,“这些疾病中的许多可能与同一机制有关。我们的下一步是深入了解货物受体,以及为何它们阻止错误折叠蛋白遭受消除,并确切地弄清楚如何开发抵抗它们的药物。”(生物谷 Bioon.com)
参考资料:
1.Moran Dvela-Levitt et al. Small molecule targets TMED9 and promotes lysosomal degradation to reverse proteinopathy. Cell, 2019, doi:10.1016/j.cell.2019.07.002.
2.Molecular traffic jam may underlie rare kidney disease, other protein misfolding disorders
https://medicalxpress.com/news/2019-07-molecular-traffic-underlie-rare-kidney.html
如今,在一项新的研究中,来自美国布罗德研究所、哈佛医学院和布莱根妇女医院的研究人员发现一些毒性蛋白病可能起源自一个以前未被认识到的原因:细胞运输网络(称为分泌途径)中单个特定步骤发生堵塞,其中这种细胞分泌途径要么将蛋白递送至细胞表面,要么将蛋白递送至细胞中的蛋白处理系统之一。相关研究结果发表在2019年7月25日的Cell期刊上,论文标题为“Small Molecule Targets TMED9 and Promotes Lysosomal Degradation to Reverse Proteinopathy”。

图片来自Cell, 2019, doi:10.1016/j.cell.2019.07.002。
这一发现来自对一种称为MUC1肾病(MUC1 kidney disease, MKD)的罕见疾病的研究,在这种疾病中,这些研究人员发现它起源自肾细胞中MUC1蛋白的错误折叠版本的有害堆积。此外,他们发现肾细胞未能移除这种错误折叠蛋白可追溯到这种细胞分泌途径中的一个特定分子步骤,而且显而易见的是,一种称为BRD4780的化合物能够清除这种堵塞。这种化合物在人肾细胞、肾脏类器官(患者细胞经改造后在培养皿中产生的微型肾脏)和MKD动物模型中起作用。BRD4780可能是开发治疗MKD和其他毒性蛋白病的新药物的起点。不过就目前而言,人们尚没有针对这些毒性蛋白病的治疗方法。
论文通讯作者、哈佛医学院副教授、布罗德研究所肾病计划主任、布莱根妇女医院肾脏专家Anna Greka说道,“我想到的是在研究MKD致病机制的过程中,我们发现了关于细胞如何处理错误折叠蛋白的迷人的新生物学特性,这些关键的新见解可能有助于我们解决几种破坏性疾病。我们的研究团队正在全天候工作,旨在将这些发现转化为我们能够尽快为患者带来的新疗法。”
运输故障
MKD是一种罕见的遗传性疾病,可导致肾功能衰竭。 2013年,由布罗德研究所主席兼创始人Eric Lander、布罗德研究所成员Mark Daly领导的一个研究团队追踪了MKD---之前称为髓质囊性肾病(medullary cystic kidney disease, MCKD)---的遗传根源:基因MUC1上增加了单个碱基。
这种基因突变导致一种截短的错误折叠蛋白(称为MUC1-fs)的产生,这种蛋白便在患者的肾细胞中聚集。随着MUC1-fs的堆积,肾细胞死亡,最终导致肾功能障碍。
为了找到可能有助于从细胞中清除MUC1-fs的药物样化合物(drug-like compound),论文第一作者、布罗德研究所肾病计划博士后研究员Moran Dvela-Levitt、Greka和他们的同事们寻求了布罗德研究所药物再利用中心---一个由3700多种处于不同药物开发阶段的化合物组成的数据库,由布罗德研究所疗法开发中心加以维护----的帮助。通过搜索这个化合物数据库,他们发现了BRD4780,即一种从未进入临床试验且因经证实不能成功作为一种降血压药物而被抛弃的化合物。Greka、Dvela-Levitt和他们的同事们发现BRD4780清除了MUC1-fs,让正常的MUC1保持不变,并阻止发生MKD突变的肾细胞死亡。
当这些研究人员仔细开展研究时,他们惊讶地发现BRD4780并不与MUC1-fs结合。更确切地说,它结合到TMED9上,其中TMED9是一种所谓的“货物受体”,沿着细胞分泌途径携带蛋白货物。
针对人肾细胞、MKD小鼠模型和患者衍生性肾脏类器官的实验显示TMED9捕获MUC1-fs。这使得这种错误折叠的蛋白不会到达溶酶体(一种细胞器,它的作用就是清除不想要的蛋白),从而导致肾细胞中的MUC1-fs升高到危险水平。
这些研究人员指出,当BRD4780与TMED9结合时,TMED9不再捕获MUC1-fs,这就使得细胞降解这种错误折叠蛋白。利用CRISPR敲除编码TMED9的基因也具有相同的效果。
Greka说道,“这是一种全新的生物学。我们并不知道像TMED9这样的货物受体能够阻断并最终干扰错误折叠蛋白的破坏。问题变成了,在其他条件下起作用的相同生物学机制是否是由错误折叠蛋白的堆积引起的?”
并不局限于肾脏
50多种疾病被认为是毒性蛋白病,包括色素性视网膜炎(RP,一种视网膜发生退化的遗传性失明)和UMOD相关肾病(UKD,另一种罕见的遗传性肾病)。Greka和她的同事们推断,细胞分泌途径存在的类似问题可能是这些疾病中至少一些的原因。
在体外实验中,这些研究人员发现BRD4780能够降低RP细胞和UKD细胞中的错误折叠蛋白水平,并增加这些细胞的存活率。Greka和她的同事们估计,类似于BRD4780的药物可能会逆转大约20种疾病,在这些疾病中,错误折叠蛋白在细胞分泌途径中较早地受到阻塞。
Greka说道,“这些疾病中的许多可能与同一机制有关。我们的下一步是深入了解货物受体,以及为何它们阻止错误折叠蛋白遭受消除,并确切地弄清楚如何开发抵抗它们的药物。”(生物谷 Bioon.com)
参考资料:
1.Moran Dvela-Levitt et al. Small molecule targets TMED9 and promotes lysosomal degradation to reverse proteinopathy. Cell, 2019, doi:10.1016/j.cell.2019.07.002.
2.Molecular traffic jam may underlie rare kidney disease, other protein misfolding disorders
https://medicalxpress.com/news/2019-07-molecular-traffic-underlie-rare-kidney.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


