Front Immunol新发现:骨髓瘤患者骨髓外泌体借HLA-G/PD-1/PD-L1扰免疫,成治疗新靶标
来源:生物谷原创 2025-09-24 14:06
本研究发现多发性骨髓瘤患者骨髓来源的细胞外囊泡数量更多,且高表达HLA-G、PD-1、PD-L1,可抑制T细胞活化及关键细胞因子分泌,HLA-G阻断能部分逆转该效应,提示其为恢复抗肿瘤免疫的潜在靶标

对于60岁以上人群而言,多发性骨髓瘤是一类需重点关注的血液系统恶性肿瘤。它通常从无症状的单克隆丙种球蛋白病(MGUS)、冒烟型多发性骨髓瘤(SMM)逐步进展,最终发展为伴随高钙血症、肾功能不全、贫血及骨损伤等器官损害的症状性疾病,其核心特征是骨髓内恶性浆细胞的克隆性扩增。近年来,细胞外囊泡(EVs,常称外泌体)作为细胞间通信的关键介质,在肿瘤免疫逃逸中的作用成为研究热点。
近日,Front Immunol发表的一项研究Bone marrow-derived extracellular vesicles from multiple myeloma patients promote adaptive immune dysfunction via HLA-G, PD-1, and PD-L1,深入揭示了多发性骨髓瘤患者骨髓来源细胞外囊泡如何通过关键分子调控,削弱机体抗肿瘤免疫功能。

该研究团队收集了42例多发性骨髓瘤患者(含31例初诊多发性骨髓瘤患者(NDMM)、11例复发/难治性多发性骨髓瘤患者(RRMM))及12例健康供体(HD)的骨髓样本。通过离心法分离骨髓血浆中的细胞外囊泡后,采用纳米颗粒追踪分析(NTA)检测其大小与浓度,结果显示:各组细胞外囊泡平均大小无显著差异(健康供体为103.8±4.34nm,多发性骨髓瘤患者整体为97.3±2.43nm,初诊患者98.55±2.76nm,复发/难治患者93.4±4.68nm);但浓度差异显著,健康供体浓度最低(均值±标准差:0.14±0.01×10¹²颗粒/ml),多发性骨髓瘤患者整体浓度(0.43±0.07×10¹²颗粒/ml,p=0.0004)显著高于健康供体,且复发/难治患者(0.77±0.18×10¹²颗粒/ml,p=0.0002)浓度高于初诊患者(0.41±0.07×10¹²颗粒/ml,p=0.0009),提示细胞外囊泡浓度或与疾病进展相关。
流式细胞术分析进一步明确细胞外囊泡的细胞来源:94.3±1.38%的细胞外囊泡表达白细胞标志物CD45,表明其主要源自白细胞;单核细胞(CD14⁺,25±4.9%)、自然杀伤细胞(NK细胞,CD16⁺,24.8±4.5%)是主要贡献者,T细胞(CD3⁺,1.7±0.71%)、B细胞(CD19⁺,1.7±0.43%)贡献较少;同时检测到7.6±4.6%的细胞外囊泡表达恶性浆细胞标志物CD138,且多发性骨髓瘤患者细胞外囊泡CD138表达(中位相对荧光强度MRFI:14.08±4.56,阳性率10.30±2.47%)显著高于健康供体(MRFI:1.85±0.33,阳性率5.13±0.88%),初诊与复发/难治患者间无显著差异。
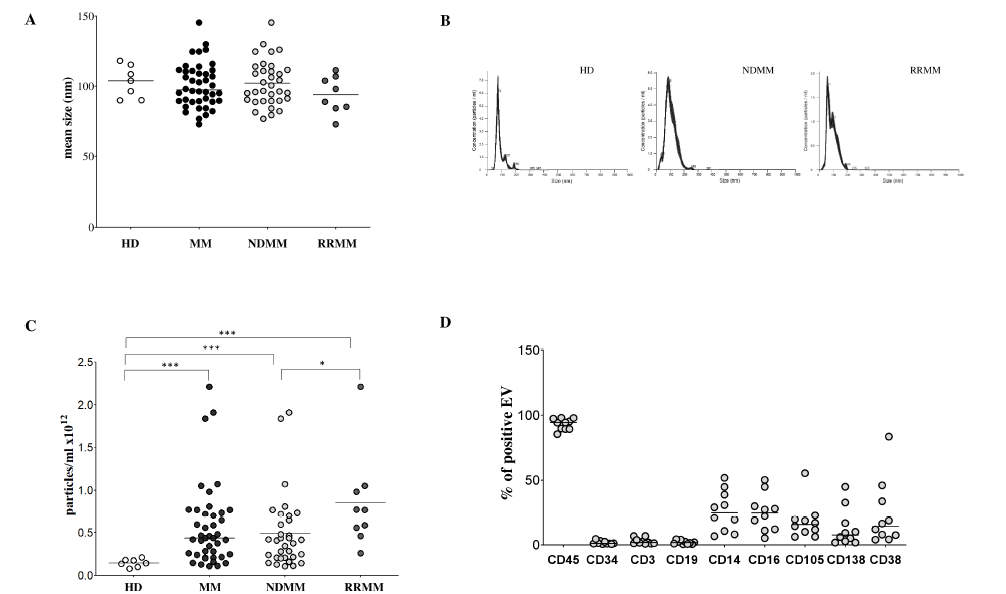
图1 骨髓样本中细胞外囊泡的特征分析
免疫检查点分子表达分析显示,多发性骨髓瘤患者细胞外囊泡上HLA-G、PD-1、PD-L1表达均显著高于健康供体:HLA-G的MRFI患者为10.91±3.08(健康供体2.29±0.23),阳性率16.24±2.53%(健康供体6.59±1.52%);PD-1的MRFI患者为3.65±2.7(健康供体1.53±0.44),但各组PD-1⁺细胞外囊泡百分比无显著差异;PD-L1表达最高且差异最显著,患者MRFI为52±14.1(健康供体9.2±2.15),复发/难治患者MRFI(78.66±31.47)显著高于初诊患者(43.49±15.69,p=0.04),患者PD-L1⁺细胞外囊泡百分比(89.63±2.17%)也显著高于健康供体(75.68±11.46%,p=0.001)。此外,CD138与HLA-G表达呈显著正相关(p<0.0001),且从多发性骨髓瘤研究基金会(MMRF)CoMMpass研究的RNA测序数据可见,恶性浆细胞中HLA-G转录本水平(log2(TPM+1))显著高于其他骨髓细胞群(p=0.0416),证实恶性浆细胞是HLA-G⁺免疫抑制性细胞外囊泡的来源之一。
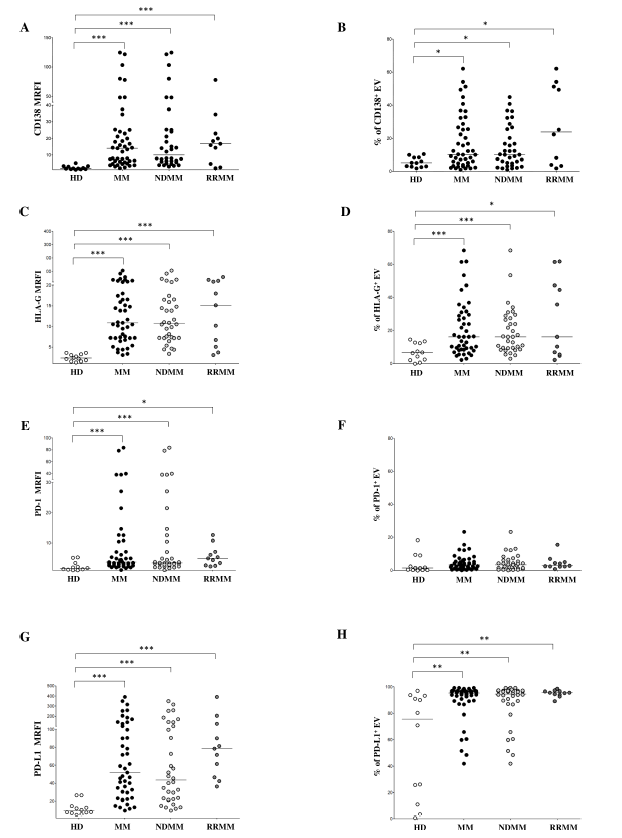
图2 骨髓样本中细胞外囊泡的表型分析
功能实验表明,多发性骨髓瘤患者骨髓来源的细胞外囊泡可显著调控免疫应答:在葡萄球菌肠毒素B(SEB)刺激的健康人外周血单个核细胞(MNCs)中,细胞外囊泡可使CD4⁺ T细胞IFN-γ⁺比例从2.7±0.06%降至1.83±0.03%(p=0.02),CD8⁺ T细胞IFN-γ⁺比例从4.11±0.08%降至2.88±0.08%(p=0.02),而抗HLA-G阻断抗体可部分恢复该效应(CD4⁺ T细胞回升至2.03±0.04%,CD8⁺ T细胞回升至3.14±0.07%,均p=0.05),抗PD-L1阻断抗体则无显著作用;细胞增殖方面,细胞外囊泡仅轻微降低CD4⁺ T细胞增殖率(从76.5±0.21%降至71.9±3.6%,p=0.02),对CD8⁺ T细胞增殖无显著影响,且两种阻断抗体均无法恢复CD4⁺或CD8⁺ T细胞增殖。
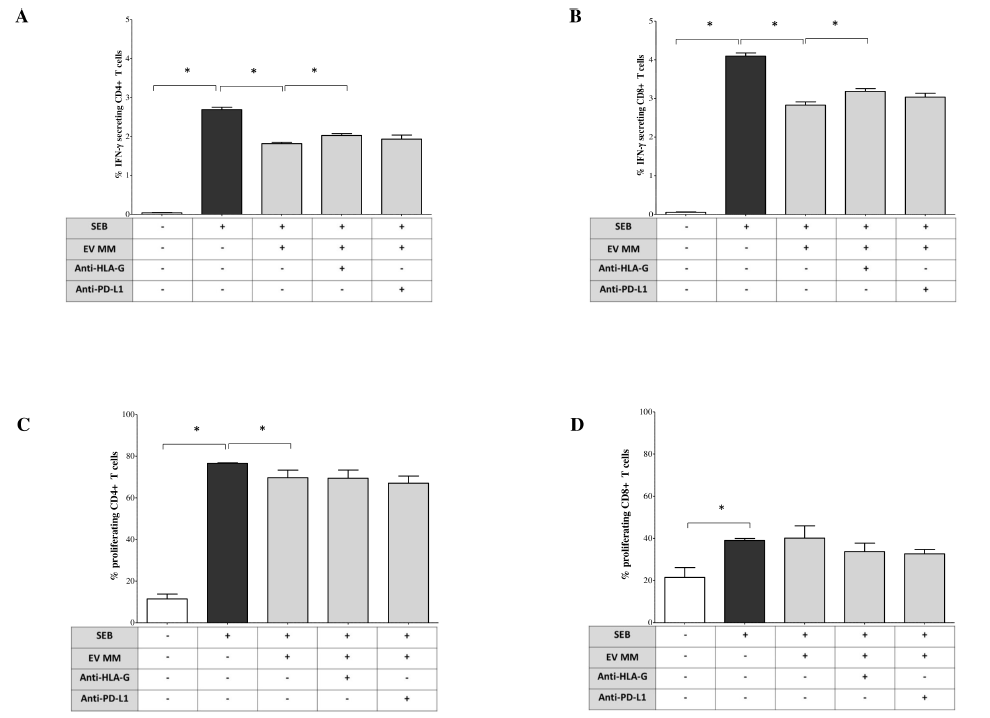
图3 多发性骨髓瘤患者骨髓来源细胞外囊泡的免疫调节功能
细胞因子分泌分析显示,细胞外囊泡可显著改变SEB刺激的单个核细胞细胞因子谱:使GM-CSF分泌从6154±49.2pg/mL升至7119±77.72pg/mL(p=0.02),抗HLA-G阻断可使其降至5660±460.2pg/mL(p=0.05);抑制IL-2分泌(从1297±80.5pg/mL降至184.5±25.73pg/mL,p=0.05),抗PD-L1阻断可部分恢复(升至243.1±25.93pg/mL,p=0.05);抑制IFN-α(从15.35±2.02pg/mL降至0±0.16pg/mL,p=0.02)、IL-10(从583±30.29pg/mL降至348.8±52.76pg/mL,p=0.02)、IL-6(从617.2±35.16pg/mL降至360.7±11.58pg/mL,p=0.02)、TNF-α(从153.7±5.84pg/mL降至132.2±5.18pg/mL,p=0.02)分泌,抗HLA-G阻断可恢复这四种细胞因子水平,抗PD-L1阻断仅能恢复IL-10和IL-6水平;IL-4分泌也被抑制(从1±0.16pg/mL降至0.6±0.11pg/mL,p=0.02),但两种阻断抗体均无法逆转。IL-5、IL-9、IL-12p70、IL-17A在各组间无显著差异,IFN-γ因超出检测上限未报告。
细胞遗传学关联分析显示,1号染色体获得(1q+)的多发性骨髓瘤患者,其恶性浆细胞中HLA-G mRNA水平显著更高(p=0.0396),提示高危细胞遗传学特征可能与细胞外囊泡介导的免疫抑制增强相关;t(4;14)易位患者的CD138⁺细胞外囊泡百分比及HLA-G表达呈升高趋势,但未达统计学显著性。
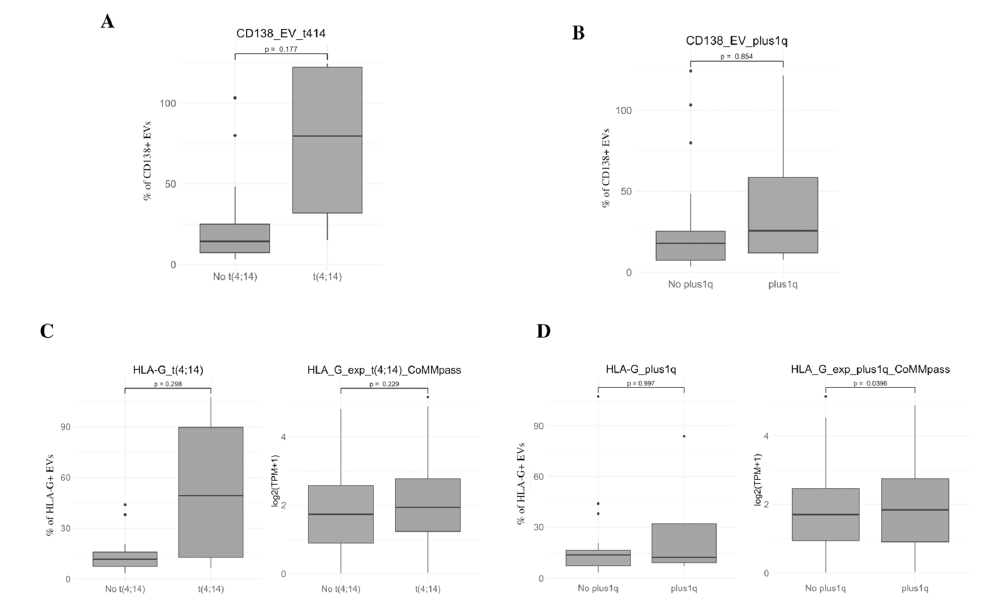
图4 细胞外囊泡标志物与细胞遗传学异常的临床关联
综上,这项研究全面阐明了多发性骨髓瘤患者骨髓来源细胞外囊泡的“免疫抑制机制”——通过富集HLA-G、PD-1、PD-L1等免疫检查点分子,从抑制T细胞活化、调控细胞因子网络两方面破坏抗肿瘤免疫,且1q染色体获得等高危细胞遗传学特征可能加剧该效应。这一发现不仅为理解多发性骨髓瘤免疫逃逸提供了新的分子机制,更明确了携带HLA-G、PD-L1的细胞外囊泡可作为潜在治疗靶标,为后续开发针对这些细胞外囊泡或其关键分子的干预策略、帮助患者重建免疫防御奠定了基础,也为多发性骨髓瘤的精准治疗开辟了新方向。(生物谷Bioon.com)
参考文献:
Soncini D, Marimpietri D, Ladisa F, et al. Bone marrow-derived extracellular vesicles from multiple myeloma patients promote adaptive immune dysfunction via HLA-G, PD-1, and PD-L1. Front Immunol. 2025;16:1640168. Published 2025 Aug 28. doi:10.3389/fimmu.2025.1640168
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


