Nat Cancer:揭示突变蛋白在某些致死性癌症中扮演的新角色
来源:生物谷原创 2024-11-30 14:03
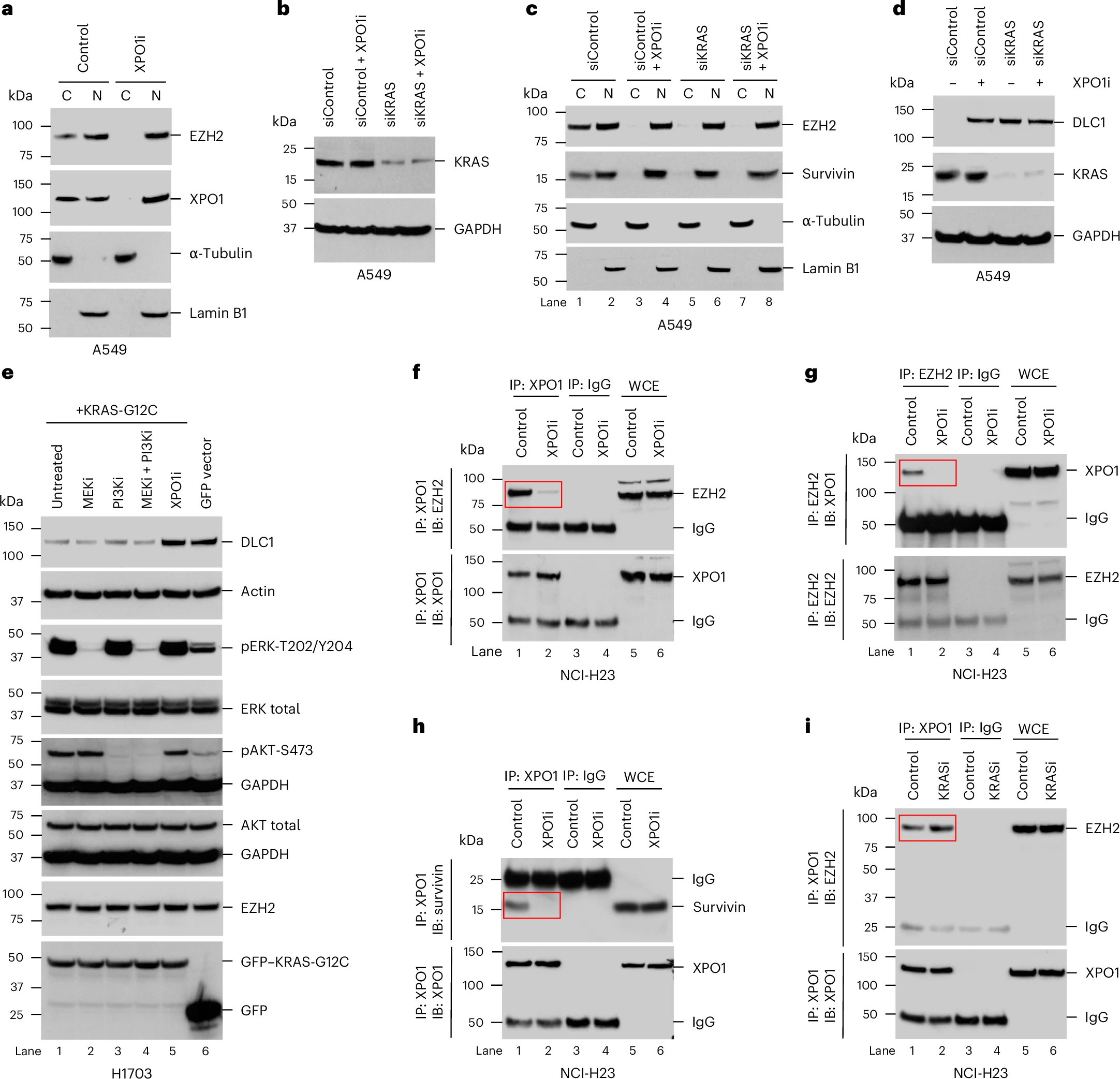
这项最新研究中,研究人员发现,突变的RAS或能直接参与到从细胞核转运到细胞质的复合体中释放名为EZH2的核蛋白的过程。
包括PI3K/AKT和RAF/MEK依赖性活性在内的典型RAS信号主要来自于RAS•GTP与其在质膜上的效应物之间的相互作用。近日,一篇发表在国际杂志Nature Cancer上题为“The pro-oncogenic noncanonical activity of a RAS•GTP:RanGAP1 complex facilitates nuclear protein export”的研究报告中,来自美国国立卫生研究院等机构的科学家们通过研究发现了一种新方式,即通常在癌症中发生突变的RAS基因或能驱动肿瘤生长,而不是在细胞表面的信号转导过程中发挥众所周知的作用。
文章中,研究人员发现,突变的RAS有助于启动一系列涉及特定核蛋白运输的事件,从而导致失控的肿瘤生长。RAS基因是癌症中第二大常见的突变基因,而突变的RAS蛋白也是其中一些最致命癌症的关键驱动因素,包括几乎所有的胰腺癌,一半结直肠癌和三分之一的肺癌。几十年的研究结果表明,突变的RAS蛋白能通过激活细胞表面的特殊蛋白来促进肿瘤发生和生长,从而就能产生一种告诉细胞生长的持续信号流。
医学博士Douglas Lowy说道,这是我们首个研究表明突变的RAS基因能以一种全新的方式来促进癌症发生,RAS蛋白的额外作用的发现或许对于改善癌症治疗也有着令人兴奋的意义。阻断RAS蛋白的药物被用作癌症疗法仅有几年时间,如今其已经被FDA批准用于治疗人类肺癌和肉瘤;尽管RAS抑制剂的开发取得了重大的科学成功,但迄今为止其对患者的治疗结局的影响仍然有限,大多数患者的生存期仅提高了几个月。
RAS或能独立于PI3K和MEK信号从而调节调节核蛋白的输出
早在35年前,研究者Lowy领导的一个小组就参与了早期的研究,并识别出了RAS或能作为致癌基因且能帮助解释为何其会促进肿瘤的生长。这项最新研究中,研究人员发现,突变的RAS或能直接参与到从细胞核转运到细胞质的复合体中释放名为EZH2的核蛋白的过程。一旦被释放,EZH2就能促进一种称之为DLC1的肿瘤抑制蛋白的分解,而阻断突变体RAS就能阻止EZH2的释放,从而恢复DLC1的活性。
通过对人类肺癌癌细胞系和肺癌小鼠模型进行实验,研究人员发现,将RAS抑制剂与能重新激活DLC1肿瘤抑制活性的不同靶向性癌症药物结合或许具有强大的抗癌潜能,这要比单独使用RAS抑制剂更有效。研究人员还发现证据表明,突变的RAS蛋白在其它癌症类型中也具有相同的功能,这就表明,这种机制或许是携带突变RAS基因癌症的普遍特征。研究人员认为,相关研究发现对于开发针对RAS所诱发癌症的新型疗法具有潜在的意义,如今他们已经开始分析RAS的功能在胰腺癌中的作用,尤其是因为目前科学家们在治疗胰腺癌上并没有有效的手段。
最后,研究者表示,考虑到RAS所扮演的关键角色,这种新型疗法组合未来有一天或能用作人类癌症的治疗。(生物谷Bioon.com)
参考文献:
Tripathi, B.K., Hirsh, N.H., Qian, X. et al. The pro-oncogenic noncanonical activity of a RAS•GTP:RanGAP1 complex facilitates nuclear protein export. Nat Cancer (2024). doi:10.1038/s43018-024-00847-5
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


