CAR-T细胞疗法研究进展(第46期)
来源:生物谷原创 2024-09-30 10:07
靶向EphA3的CAR-T细胞疗法有望治疗胶质瘤、新研究表明CAR-T细胞治疗后继发性癌症的风险可能与其他癌症治疗后的风险相似、新研究表明靶向EphA3的CAR-T细胞有望治疗胶质母细胞瘤
CAR-T (Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良,并使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点!
1.JITC:靶向EphA3的CAR-T细胞疗法有望治疗胶质瘤
doi:10.1136/jitc-2024-009486
在一项新的研究中,来自沃尔特和伊丽莎-霍尔医学研究所(WEHI)的研究人员发现了一种很有前景的二合一新疗法,它不仅能靶向摧毁一种侵袭性脑癌,还能帮助免疫系统形成对这种癌症的持久防御。这种双效疗法使用一种称为CAR-T细胞疗法的特殊免疫疗法来治疗胶质瘤,其中胶质瘤是一种难以治愈的脑癌,治疗方法很少。相关研究结果近期发表在Journal for ImmunoTherapy of Cancer期刊上,论文标题为“EphA3-targeted chimeric antigen receptor T cells are effective in glioma and generate curative memory T cell responses”。

图片来自Journal for ImmunoTherapy of Cancer, 2024, doi:10.1136/jitc-2024-009486
虽然CAR-T细胞疗法已显示出治疗脑癌的前景,但寻找合适的蛋白来靶向脑癌细胞一直是一大障碍。这项新的研究揭示了一种存在于高级别胶质瘤细胞表面的名为EphA3的蛋白,该蛋白可能是CAR-T细胞疗法的关键靶点。
论文通讯作者、WEHI实验室主任Misty Jenkins AO教授说,这一发现的潜在影响是深远的。Jenkins说,“这种治疗胶质瘤的新方法可能会为患者提供一条潜在的生命线。我们的研究表明,在实验室测试和动物模型中,靶向EphA3的CAR-T细胞都能有效地寻找并消灭胶质瘤细胞。这种疗法不仅能靶向杀死癌细胞,还能引发持久的免疫反应,防止肿瘤今后生长。我们从未预料到这种二合一的突破可以提供如此多的拯救生命的可能性。这是一个重要的进展,因为神经胶质瘤的治疗非常具有挑战性,目前的选择也很有限。最重要的是,这可能意味着患者的生存时间会延长,生活质量会提高,给那些受这些侵袭性癌症影响的患者带来希望。”
2.Clin Cancer Res:新研究表明CAR-T细胞治疗后继发性癌症的风险可能与其他癌症治疗后的风险相似
doi:10.1158/1078-0432.CCR-24-1798
2024 年 1 月,美国食品药品管理局(FDA)要求所有目前可用的 CAR-T 细胞疗法的标签信息都必须包括一个黑框警告,告知处方者和患者在接受 CAR-T 治疗后出现继发性癌症的潜在风险。具体来说,黑框警告提醒患者有可能患上与接受 CAR-T细胞治疗的 B 细胞淋巴瘤或多发性骨髓瘤无关的新 T 细胞癌症。这一决定主要是基于 FDA 不良事件报告系统的数据。
不过,纪念斯隆-凯特琳癌症中心成人骨髓移植服务处客座研究员Kai Rejeski医学博士解释说,一些科学家担心这些数据可能存在固有偏差,包括报告偏差。
Rejeski指出,在评估第二原发恶性肿瘤(second primary malignancy, SPM)风险时,必须考虑年龄、随访时间、接受的CAR-T细胞疗法类型、患者的初步诊断或患者在接受CAR-T细胞治疗前可能接受的其他类型治疗等混杂因素。
Rejeski及其同事们对淋巴瘤或多发性骨髓瘤成年患者接受目前获批的六种CAR-T细胞疗法之一的临床研究进行了系统回顾和荟萃分析: idecabtagene vicleucel (Abecma)、lisocabtagene maraleucel (Breyanzi)、ciltacabtagene autoleucel (Carvykti)、tisagenlecleucel (Kymriah)、brexucabtagene autoleucel (Tecartus)或axicabtagene ciloleucel (Yescarta)。
相关结果于2024年9月20日在线发表在Clinical Cancer Research期刊上,论文标题为“Second Primary Malignancies after CAR T-Cell Therapy: A Systematic Review and Meta-analysis of 5,517 Lymphoma and Myeloma Patients”。
研究中包含的四项临床试验评估了接受患者接受CAR-T细胞疗法治疗与标准治疗方案的疗效对比。在这些研究的1253名患者中,接受CAR-T细胞治疗的患者的SPM发生率为5%,而接受标准治疗方案的患者的SPM发生率为4.9%,两者差异无统计学意义。
Rejeski说,“这些数据并不表明,与其他标准疗法相比,SPM的风险会增加。我担心这类警告标签可能会恐吓接受这种疗法的患者,这可能并不完全有根据。”
Rejeski进一步解释说,这些数据可能有助于确定哪些特定因素会增加接受CAR-T细胞治疗的患者发生SPM的风险,例如,SPM的发生率随着先前治疗次数的增加而增加,这可能反映了先前几种疗法造成的累积性损伤。
3.JITC:新研究表明靶向EphA3的CAR-T细胞有望治疗胶质母细胞瘤
doi:10.1136/jitc-2024-009403
在一项新的研究中,来自澳大利亚昆士兰医学研究所等研究机构的研究人员开发出了一种前景广阔的 CAR-T 细胞免疫疗法。他们的早期临床前研究结果表明它可以杀死胶质母细胞瘤细胞,并有潜力防止这种致命的脑癌复发。相关研究结果于2024年8月7日在线发表在Journal for ImmunoTherapy of Cancer期刊上,论文标题为“EphA3 CAR T cells are effective against glioblastoma in preclinical models”。
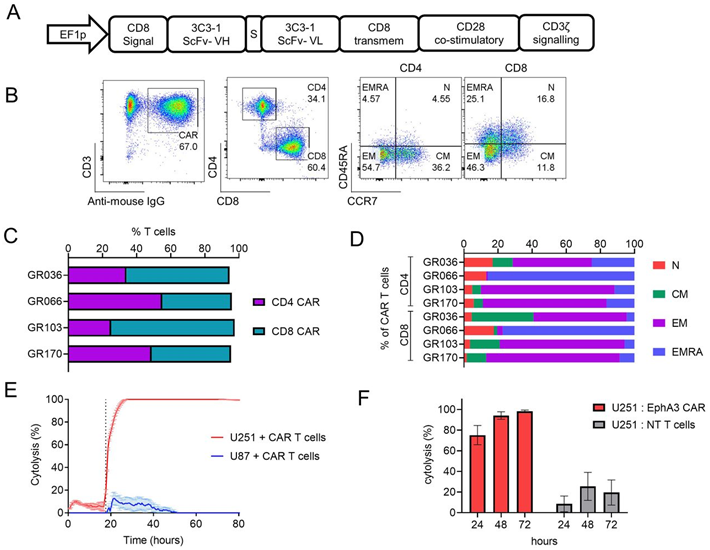
图片来自Journal for ImmunoTherapy of Cancer, 2024, doi:10.1136/jitc-2024-009403
论文共同通讯作者、昆士兰医学研究所的Rajiv Khanna AO教授说,“这种疗法专门针对癌细胞,有潜力防止疾病复发,这对患上这种致命疾病的患者来说是一个突破。如果能预防复发,这种原发性脑癌通常可以得到控制。不幸的是,一旦这种脑癌复发,目前的预期寿命通常不到六个月。我们的目标是通过在疾病的早期阶段进行治疗来预防复发。”
Khanna教授说,“这些发现对未来的癌症治疗具有极大的鼓舞作用。临床前研究结果表明这些杀伤性CAR-T细胞可以附着在新形成的癌变血管和干细胞上并将其摧毁,从而消灭大脑内治疗抵抗性的肿瘤细胞。”
这些CAR-T细胞表达的嵌合抗原受体(CAR)能够让它们找到并攻击一种名为EphA3的蛋白,这种蛋白常见于胶质母细胞瘤中。
4.Clin Cancer Res:新研究表明CXCR2或CXCR6可提高B7-H3-CAR T细胞在骨肉瘤中的归巢能力
doi:10.1158/1078-0432.CCR-23-3298
法。尽管这种方法已经在某些类型的白血病治疗中取得成功,但对于小儿实体瘤的治疗效果却不尽如人意。
最近,圣犹大儿童研究医院的研究人员发现了一种改进 CAR-T 细胞疗法的方法,该方法能增强 T 细胞定位并攻击骨肉瘤的能力。这项研究提高了 CAR-T 细胞找到并进入肿瘤部位的效率,这对于设计更有效的 CAR-T 细胞疗法至关重要。相关研究结果于2024年8月5日在线发表在Clinical Cancer Research期刊上,论文标题为“Redirecting B7-H3.CAR T cells to Chemokines Expressed in Osteosarcoma Enhances Homing and Antitumor Activity in Preclinical Models”。
人类体内大约有 50 种趋化因子和 20 种趋化因子受体。为了提高CAR-T细胞对骨肉瘤的归巢能力,Talbot团队必须首先确定这种特定癌症类型表达哪些趋化因子。
Talbot解释说,“我们利用手术后收集的患者样本来指导我们确定哪些趋化因子是骨肉瘤中的趋化因子,并对这种肿瘤产生的趋化因子进行未知筛选---这是我们所能的最接近患者体内发生的情况。当你将其与基因表达数据相结合时,你就会得到非常可靠的结果,知道哪些趋化因子对特定类型的癌症很重要。”
利用这种方法,Talbot团队确定了骨肉瘤分泌的两种趋化因子——CXCL8 和 CXCL16。然而,CAR-T 细胞并不表达这两种趋化因子的受体。
在确定了这种趋化因子/趋化因子受体不匹配的情况后,Talbot团队对靶向骨肉瘤抗原B7-H3的CAR-T细胞进行基因改造,使其表达已确定的趋化因子受体(CXCR2或CXCR6)。他们评估了改造后的CAR-T细胞的归巢动态(移动)和效率,即测试它们发现和浸润骨肉瘤的能力。
他们发现这些改造后的CAR-T细胞的表现各不相同。表达CXCR2的CAR-T细胞能迅速归巢并到达肿瘤,但是它们的活性在早期就趋于稳定。表达CXCR6的CAR-T细胞归巢时间稍长,但也同样趋于平稳。值得注意的是,他们在转移性疾病模型中观察到,与未经过基因改造的B7-H3-CAR T细胞相比,改造后表达CXCR2或CXCR6的B7-H3-CAR T细胞可延长生存期。
5.JCO:新研究追踪了接受CAR-T细胞疗法axi-cel治疗的大 B 细胞淋巴瘤患者的临床预后
doi:10.1200/JCO.23.02786
Axicabtagene ciloleucel,俗称axi-cel,是一种创新的CAR-T细胞免疫疗法,它利用改良的T细胞靶向摧毁癌细胞。axi-cel已获准用于对至少两种先前疗法无效的患者,在治疗大 B 细胞淋巴瘤方面引发变革。
虽然最初的研究显示了良好的短期疗效,但长期存活率数据却很少。然而,一项新的研究提供了至关重要的长期视角。这项研究由莫菲特癌症中心牵头,联合其他16家美国学术癌症中心共同完成,对275名接受了axi-cel治疗的患者进行了随访,跟踪他们的病情进展,中位时间为58个月。相关研究结果于2024年8月2日在线发表在Journal of Clinical Oncology期刊上,论文标题为“Five-Year Follow-Up of Standard-of-Care Axicabtagene Ciloleucel for Large B-Cell Lymphoma: Results From the US Lymphoma CAR T Consortium”。
他们的结果显示,29%的患者在治疗后第5年经历无进展生存,40%的患者在治疗后第5年达到了总生存率。淋巴瘤特异性5年生存率为 53%,表明许多患者仍然没有癌症。这些研究结果与之前的临床试验结果一致,凸显了axi-cel在现实世界中的有效性。
论文通讯作者、莫菲特癌症中心的Michael Jain博士说,“我们的研究表明,axi-cel能为相当一部分复发或难治性大B细胞淋巴瘤患者带来持久的疗效。鉴于这些患者以前的选择有限,这一点尤其值得注意。”
6.Nat Med:靶向ROBO1的CAR-T细胞有望治疗包括胶质母细胞瘤在内的多种脑癌
doi:10.1038/s41591-024-03138-9
在一项新的研究中,来自麦克马斯特大学、加拿大国家研究委员会、弗吉尼亚大学、匹兹堡大学和玛格丽特公主癌症中心的研究人员发现了癌细胞渗入大脑的新途径。他们还揭示了一种有望阻断和杀死这些肿瘤的新疗法。这一发现为胶质母细胞瘤这种最具侵袭性的脑癌提供了新的希望和潜在的治疗方法。相关研究结果于2024年8月2日在线发表在Nature Medicine期刊上,论文标题为“Targeting axonal guidance dependencies in glioblastoma with ROBO1 CAR T cells”。
图片来自Nature Medicine, 2024, doi:10.1038/s41591-024-03138-9
为了阻止癌细胞的浸润,研究者采用了不同的策略,包括弗吉尼亚大学John Lazo研究团队开发的一种药物,以及在加拿大国家研究委员会的Kevin Henry和Martin Rossotti的帮助下开发的一种新疗法。他们着重关注一种名为Roundabout Guidance Receptor 1(ROBO1)的蛋白,这种蛋白有助于引导某些细胞。
论文第一作者Chirayu Chokshi说,“我们构建出一种细胞疗法,即从患者身上提取T细胞,对它们进行基因编辑后,并赋予其新的功能。具体而言,我们制造出的CAR-T细胞具备了在动物模型中寻找肿瘤细胞表面上的ROBO1的知识和能力。”
Singh和Chokshi说,这种治疗方法也适用于其他侵袭性脑癌。在这项新的研究中,他们研究了三种不同类型的癌症模型,包括成人胶质母细胞瘤、成人肺脑转移瘤和小儿髓母细胞瘤。在这三种模型中,这种治疗都能使生存时间延长一倍。在其中的两种癌症模型中,至少有50%的小鼠的肿瘤被根除。
7.开启CAR-T细胞疗法持久战力新时代!Nat Biotechnol:CAR-E可让CAR-T细胞在体内长时间存活,并阻止癌症在CAR-T细胞治疗后复发
doi:10.1038/s41587-024-02339-4
尽管CAR-T细胞疗法为癌症治疗领域带来了革命性的进展,尤其在针对某些B细胞血液癌症如白血病、淋巴瘤和多发性骨髓瘤的治疗上取得了显著成效,但这种疗法仍面临一个重大挑战:许多患者即便经历短暂的完全缓解后,癌症最终还是会复发。
针对这一难题,丹娜法伯癌症研究院的研究团队近日宣布了一项创新性的解决方案,他们开发了一种名为CAR增强剂(CAR-E)的新型治疗平台,旨在提升CAR-T细胞的活性和持久性,从而避免癌症复发。相关研究结果于2024年7月30日在线发表在Nature Biotechnology期刊上,论文标题为“A CAR enhancer increases the activity and persistence of CAR T cells”。
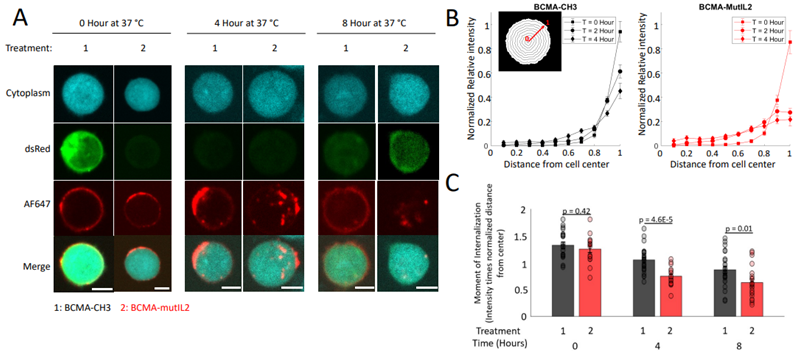
图片来自Nature Biotechnology, 2024, doi:10.1038/s41587-024-02339-4
CAR-E治疗平台的独特之处在于它能够刺激CAR-T细胞维持活跃状态,延长其在患者体内的存活时间,确保它们能够持续战斗直至彻底清除肿瘤细胞。
此外,CAR-E还能促使CAR-T细胞形成对癌细胞的记忆,一旦癌症复发,这些记忆细胞便能迅速重新激活,再次投入战斗。在实验室的患者来源癌症细胞系实验中,CAR-E治疗已证实能够彻底消灭肿瘤细胞,为该疗法在人类患者身上的临床应用铺平了道路。
论文通讯作者、丹娜法伯癌症研究院的Mohammad Rashidian 博士表示:“尽管CAR-T细胞疗法在治疗B细胞血液癌症方面取得了突破,但几乎所有患者最终都会出现复发,尤其是在多发性骨髓瘤的治疗中。我们面临的挑战是如何使CAR-T细胞在体内保持更长的活性和持久性。为此,我们采取了一种全新的策略,而不是简单地对CAR-T细胞本身进行改造。”
Rashidian和他的团队开发了一个独特的“平台”工具,它能够从外部刺激CAR-T细胞,延长它们的寿命并促进记忆细胞的形成。这一工具是一种融合分子,包含一种弱化形式的免疫信号分子——白细胞介素-2(IL-2),以及CAR-T细胞识别的特定抗原。这种弱化形式的IL-2对正常T细胞影响微乎其微,但当与抗原结合并特异性地作用于CAR-T细胞时,却能显著激活和增殖这些细胞。
研究团队发现,CAR-E疗法不仅能促进CAR-T细胞的增殖,还能使它们多样化,产生各种类型的记忆T细胞,包括干细胞样记忆T细胞、中枢记忆T细胞和效应记忆T细胞,这些细胞对于构建全面的癌症免疫反应至关重要。在骨髓瘤细胞的实验室培养物和动物模型中,CAR-E疗法成功实现了肿瘤细胞的完全清除,且产生的长效CAR-T细胞可以通过后续的CAR-E治疗再次激活,为复发患者提供了新的治疗机会。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


