Cell Rep:冯新华实验室阐述gasdermin A激活细胞焦亡的机制
来源:生物探索 2024-10-04 09:38
本研究首次揭示了内源激活GSDMA的分子机制,并且表明非蛋白剪切的翻译后修饰亦可作为GSDM蛋白家族的激活机制。
浙江大学生命科学研究院冯新华实验室在Cell Reports上发表题为Starvation-induced phosphorylation activates gasdermin A to initiate pyroptosis的研究论文。该研究阐明了介导细胞焦亡的gasdermin家族的成员GSDMA在细胞饥饿条件下被磷酸化激活的机制(图1)。

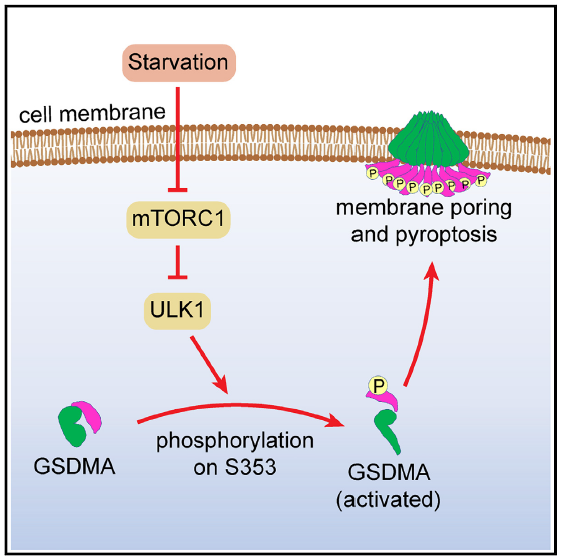
图1. GSDMA在细胞长时间饥饿条件下可被活化的ULK1激酶磷酸化其353位点的丝氨酸,解除分子内自抑制并在细胞膜表面形成穿孔介导细胞焦亡(Credit: Cell Reports)
本研究早期发现,TGF-β诱导了GSDMA的表达。但进一步工作发现,它跟TGF-β诱导细胞死亡无关。不过有趣的是,在细胞氨基酸饥饿且ATP严重消耗的条件下,细胞内响应饥饿的磷酸激酶ULK1被激活,并导致GSDMA的353位点的丝氨酸磷酸化。磷酸化后的GSDMA丧失了其C端对N端结构域的自抑制作用,导致GSDMA被激活、寡聚化并介导细胞焦亡。在胃肿瘤细胞系中敲除GSDMA后的小鼠原位成瘤实验中,GSDMA敲除细胞系其肿瘤生长更迅速,且更快导致宿主小鼠的死亡,表明GSDMA具备抑制胃癌发展与恶化的作用。此外,持续性激活的GSDMA会导致小鼠的皮肤炎症及免疫浸润,提示GSDMA参与皮肤系统的免疫响应。本研究首次揭示了内源激活GSDMA的分子机制,并且表明非蛋白剪切的翻译后修饰亦可作为GSDM蛋白家族的激活机制。此外,本研究的结果对胃癌及皮肤炎症的防治也具有潜在的推动作用。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


