《免疫学》:发现肿瘤囚禁免疫细胞的窝点!华人科学家发现,瘤内缺氧区域吸引和封闭免疫细胞,并进行免疫抑制重编程
来源:奇点糕 2023-07-19 15:20
Hongyan Zou等人揭示,在胶质母细胞瘤(GBM)中,缺氧区域是肿瘤相关巨噬细胞分布状态和免疫抑制的主要驱动因素。
以虚假信息作为诱饵招募人们前往,随后限制其人身自由,进行洗脑或胁迫,诱导实施犯罪行为并利用其吸引更多不明真相的人前来……
自从前几年“这里是缅甸北部”的网络热梗火起来之后,现实中的残酷案例接连击破美好的假象。面对极具诱惑力的虚假薪资待遇,人们欣然前往,却不料正中诈骗集团的圈套,反倒成为犯罪“工具人”。
真没想到,这事儿也会出现在肿瘤中的免疫细胞身上,诈骗窝点为肿瘤内的缺氧区域。
美国西奈山伊坎医学院的Hongyan Zou和她的同事们发现,在胶质母细胞瘤(GBM)中,缺氧区域的肿瘤细胞会招募肿瘤相关巨噬细胞(TAMs)和细胞毒性T细胞(CTLs),限制其分布在缺氧区域内,并对其重编程以表达免疫抑制特征,而这会吸引来更多的TAMs和CTLs。
通过靶向缺氧区域进行治疗来改变TAMs在肿瘤内的分布,可以减少小鼠肿瘤负荷。文章于近日发表在Immunity期刊上[1]。

论文首页截图
胶质母细胞瘤(GBM)是最常见的原发性脑肿瘤之一,因其免疫活性较低、属于“冷肿瘤”,导致相关免疫疗法面临困境。
在胶质母细胞瘤中,肿瘤相关巨噬细胞(TAMs)占据很大部分比例,被证明可促进肿瘤的生长和免疫抑制。目前,靶向TAMs的策略在动物模型中显示出前景,但在患者中尚未取得生存益处。此次,Hongyan Zou团队试图通过了解TAMs在肿瘤中所处空间或生态位特点,来破解TAMs所介导的免疫抑制。
首先,研究者们利用同一种胶质母细胞瘤细胞系(GL261),构建了两种不同免疫状态的胶质母细胞瘤小鼠模型,进行对比。
结果显示,免疫功能正常的小鼠,TAMs随肿瘤进展呈现高度异质性的空间分布模式。在肿瘤进展期间,血管重塑、新生血管形成,肿瘤内血管由最初密集而规则的网络逐渐转变为稀疏、扩张扭曲、杂乱的结构;与此同时,TAMs在肿瘤内的定位发生变化。在肿瘤早期阶段(3周时),单核细胞来源的TAMs进入肿瘤,分布于正常的血管周围,随后(4周时)迁移至血管异常的区域。
相比之下,缺乏功能性T细胞、B细胞的免疫缺陷小鼠,肿瘤内血管保持密集和规律的排列状态,且TAMs分布均匀,没有明显的聚集现象。
也就是说,TAMs的空间分布与肿瘤血管重塑密切相关,而适应性免疫加剧了血管异常。
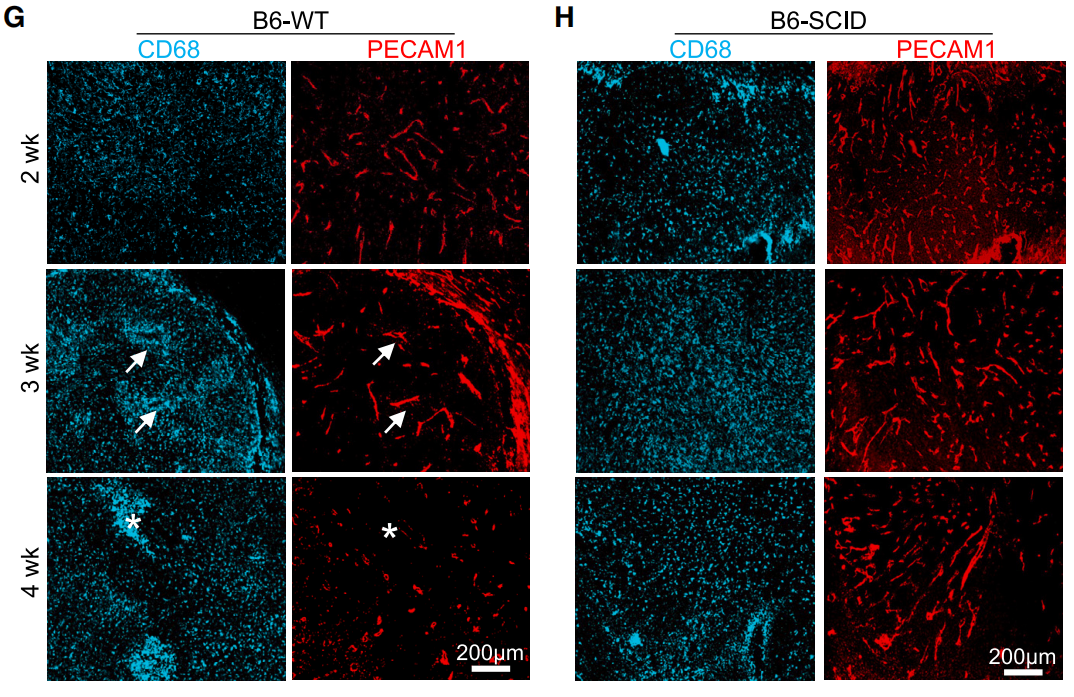
TAMs分布与血管重塑相关
由于血管异常通常会导致低氧供应,研究者们进一步探索TAMs的分布是否受缺氧因素的影响。
结果表明,与血管重塑过程一致,免疫功能正常的小鼠肿瘤内逐渐形成缺氧区域,而免疫缺陷的小鼠即使已经进入晚期,肿瘤内也没有出现明显较大的缺氧区域。
进一步研究表明,缺氧区域就好比泥潭,让TAMs陷入其中难以脱身。环绕在缺氧区域周围肿瘤细胞形成花环状聚集,即假栅栏状排列(pseudopalisades),将TAMs包围起来,并限制TAMs离开异常血管附近的缺氧区域。
这些结果不仅在由其它细胞系构建的胶质母细胞瘤小鼠模型中可以观察到,胶质母细胞瘤患者的样本观察结果同样如此。利用71名患者的样本,研究者们发现,肿瘤缺氧程度、TAMs在缺氧区域的积累水平与肿瘤分级呈正相关,并且与肿瘤亚型有关。在预后更差、侵袭性更高的间充质亚型(MES)胶质母细胞瘤中,肿瘤缺氧程度更高,受困于缺氧区域的TAMs水平更高。
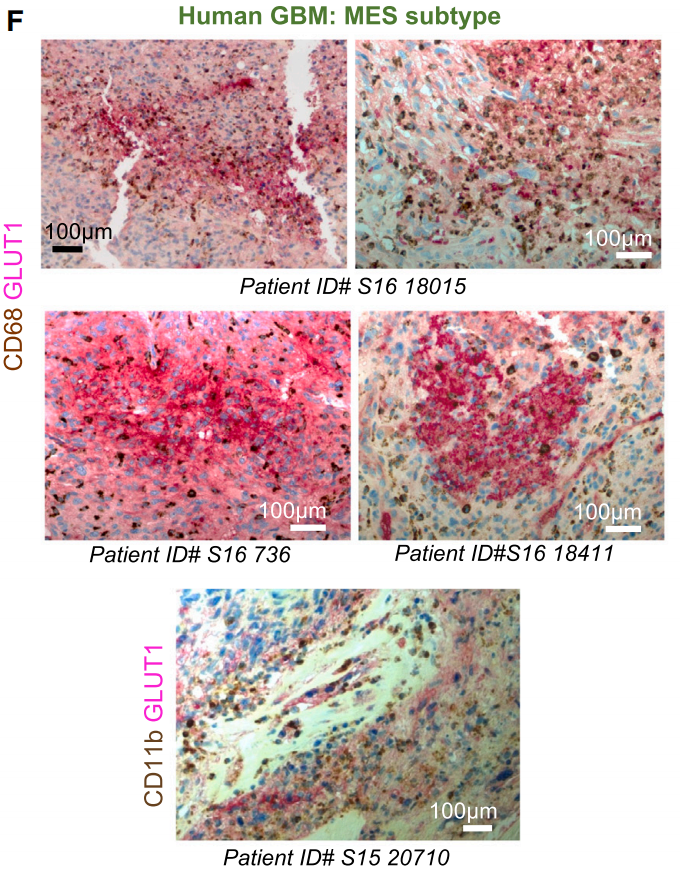
TAMs被肿瘤细胞围在缺氧区域里
随后的研究结果显示,通过放疗或缺氧激活前体药物(Evofosfamide)靶向破坏肿瘤内缺氧区域,可以“营救”TAMs、改变TAMs的分布模式,减少小鼠肿瘤负荷。联合治疗的效果更好。
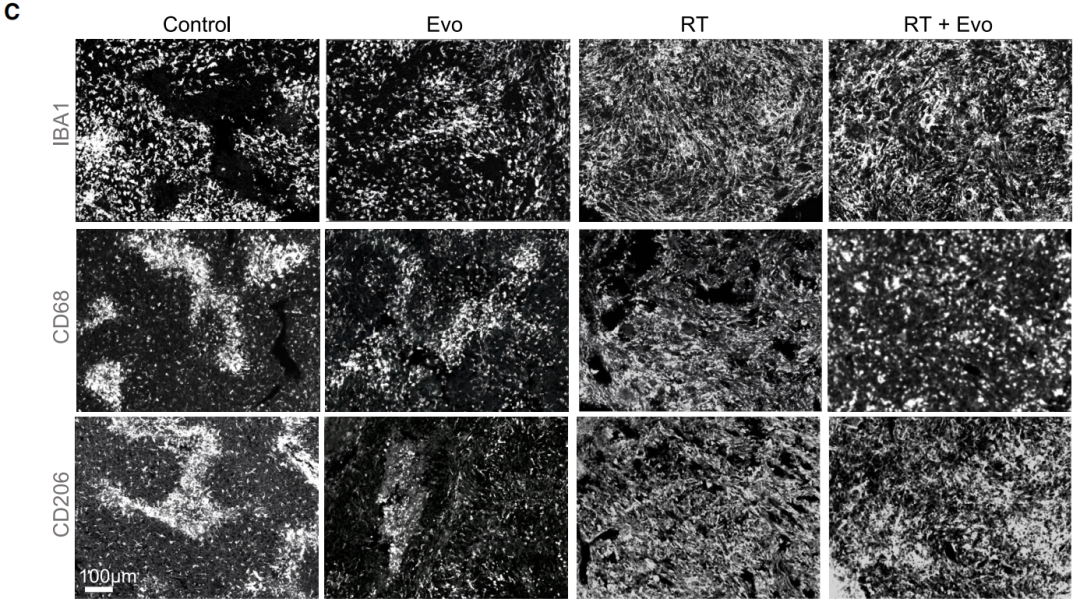
治疗后TAMs分布均匀
围困在肿瘤缺氧区域期间,TAMs究竟经历了什么?
利用单细胞RNA测序等技术,研究者们试图找出肿瘤缺氧区域内,免疫细胞与肿瘤细胞之间的互作关系。结果发现,缺氧和非缺氧环境下,胶质母细胞瘤细胞、TAMs的基因表达均存在显著差异。
一方面,缺氧环境下,肿瘤细胞表达与免疫抑制、缺氧相关的基因特征,免疫系统的正调控因子表达下调、负调控因子表达上调,代谢、血管生成、趋化因子等通路的基因表达模式发生改变。
另一方面,缺氧环境中的TAMs可分为8个亚群,每个亚群具有不同的功能特征,例如促炎反应、增殖、代谢、T细胞激活等。其中,一个与血管生成相关的TAMs亚群(sc-3)表现出缺氧相关基因特征以及免疫耐受标志物。除此之外,肿瘤缺氧区域还“囚禁”着细胞毒性T细胞(CTLs),CTLs表现缺氧相关和免疫耗竭特征。
这些表明,缺氧环境可能改变了这群免疫细胞的功能,使其丧失原本的抗肿瘤免疫作用。
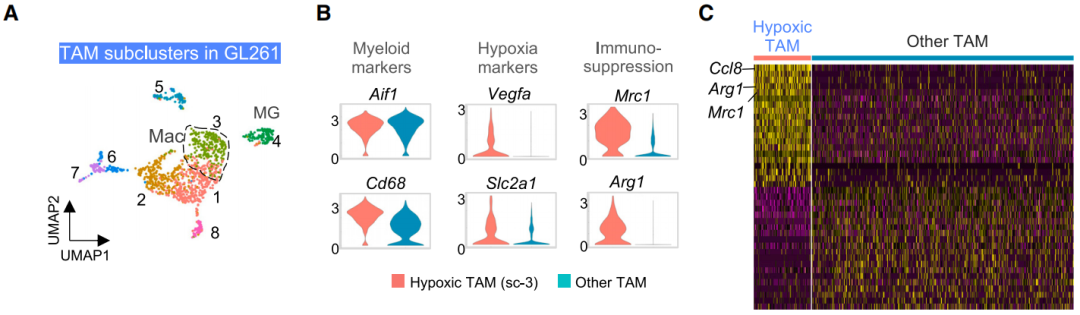
肿瘤小鼠或患者的瘤内缺氧区域中的TAMs亚群,部分亚群表现出免疫耐受特征
从机制来看,缺氧区域的肿瘤细胞通过细胞间粘附分子(ICAM-1)等信号通路,来招募TAMs、CTL与之结合,定位到缺氧区域。在这里,肿瘤细胞通过细胞间互作和通讯对TAMs、CTLs进行重编程,诱导它们表达种种免疫抑制特征。
其中,在肿瘤细胞的诱导下,TAMs大量表达CCL8、IL-1β,这两种细胞因子会进一步促进更多TAMs和CTLs往缺氧区域中迁移,以及帮助缺氧区域肿瘤细胞排列成致密的环形聚集、形成成熟的假栅栏状结构,紧紧围住免疫细胞,使其滞留。
引诱,洗脑,钓来其它同胞好友。熟悉的套路,妥妥的肿瘤诈骗窝点。
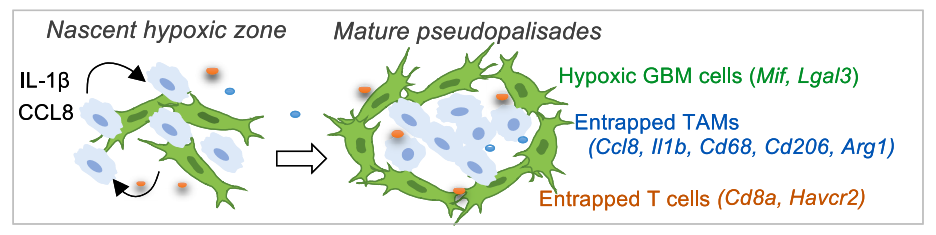
缺氧区域的肿瘤细胞钓来TAMs,并利用其形成完整的缺氧区域结构
最后,胶质母细胞瘤患者的数据分析结果证实,CCL8、IL-1β等缺氧相关因子在肿瘤内缺氧区域高表达,而且与更严重的胶质母细胞瘤亚型以及患者不良预后相关。
总体来说,Hongyan Zou等人揭示,在胶质母细胞瘤(GBM)中,缺氧区域是肿瘤相关巨噬细胞分布状态和免疫抑制的主要驱动因素。
这项研究为胶质母细胞瘤的治疗提供了新的思路,比如联合放疗+化疗靶向治疗缺氧区域,或靶向CCL8和IL-1β进行治疗,可能有助于改善胶质母细胞瘤的免疫抑制并提高治疗效果。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


