Science丨汤其群团队发现青蒿素类衍生物可治疗多囊卵巢综合征并揭示其机制
来源:生物探索 2024-06-18 11:56
研究人员发现青蒿素能够靶向线粒体蛋白酶LONP1,促进LONP1与其底物CYP11A1的结合,加速CYP11A1的降解,抑制卵巢雄激素的合成,降低PCOS患者的雄激素水平,改善月经周期及卵巢多囊样变。
多囊卵巢综合征(polycystic ovary syndrome,PCOS)又称Stein-Leventhal综合征,由Stein和Leventhal于1935年首次报道【1】。PCOS是最常见的生殖内分泌紊乱疾病之一,也是育龄期女性不孕的首要原因,全球发病率约为10%-13% 【2】。PCOS是一种高度异质性的疾病,可由环境和遗传共同诱导发病。根据2003年鹿特丹诊断标准,PCOS的诊断需存在以下三种临床表现中的任意两种:不排卵或稀发排卵、高雄激素血症和/或高雄激素的临床表现,以及卵巢多囊样改变【2】。除了上述特征外,PCOS患者常伴有肥胖,胰岛素抵抗,2型糖尿病等代谢异常,后期还可并发心血管疾病、高血压、生殖系统肿瘤以及精神异常等疾病,严重影响女性生殖健康和生命质量【1】。雄激素升高是PCOS患者的典型症状之一,也是导致PCOS患者卵泡发育受损、排卵异常及子宫内膜病变的主要驱动因素,因此控制PCOS患者雄激素水平是治疗PCOS的主要策略。然而,目前PCOS发生以及高雄激素血症的发病机制尚不清楚,治疗手段十分有限,并且均为对症治疗,效果并不理想。
青蒿素是来源于黄花蒿的倍半萜内酯化合物,作为疗效稳定且副作用小的一线抗疟疾药物应用于临床【3】。除了其经典的抗疟作用之外,近年来青蒿素类衍生物在治疗自身免疫性疾病,代谢性疾病及某些类型肿瘤方面展现出较大前景。复旦大学汤其群教授团队早期系统筛选了促进白色脂肪棕色化的小分子化合物,发现青蒿素类衍生物能够激活产热脂肪,降低肥胖小鼠体重并改善糖脂代谢(Cell Research,2016)【4】。
2024年6月13日,在汤其群教授带领下,复旦大学附属中山医院团队联合基础医学院团队合作在Science杂志上在线发表了题为Artemisinins ameliorate polycystic ovarian syndrome by mediating LONP1-CYP11A1 interaction的研究论文,发现青蒿素类衍生物能够显著改善PCOS的疾病表型。研究人员发现青蒿素能够靶向线粒体蛋白酶LONP1,促进LONP1与其底物CYP11A1的结合,加速CYP11A1的降解,抑制卵巢雄激素的合成,降低PCOS患者的雄激素水平,改善月经周期及卵巢多囊样变。

为了探究青蒿素对PCOS发生发展的影响,研究人员建立了PCOS样的大鼠及小鼠模型,并使用青蒿素类衍生物蒿甲醚处理该模型,发现蒿甲醚能够显著抑制血清雄激素水平,改善动情周期,降低卵巢中囊状卵泡的数量,并且能够提高PCOS样大鼠的生育能力。雄激素的合成来源于胆固醇,在卵巢膜细胞中胆固醇经CYP11A1催化产生孕烯醇酮【5】,并在HSD3B2、CYP17A1及HSD17一系列酶的催化下产生雄激素。研究人员使用青蒿素类衍生物蒿甲醚,青蒿琥酯及SM934处理卵巢膜细胞,发现青蒿素类衍生物能够剂量依赖的抑制细胞上清中雄激素水平。此外,雄激素合成过程中的上游激素包括孕烯醇酮,17α-羟孕酮,孕酮等水平均受到青蒿素类衍生物抑制。
为了明确青蒿素抑制雄激素合成的机制,研究人员通过蛋白组学分析蒿甲醚处理的卵巢膜细胞中差异表达蛋白,发现CYP11A1表达下调最为显著。CYP11A1是雄激素合成的限速酶,催化胆固醇转变为孕烯醇酮【5】。细胞研究发现青蒿素类衍生物能够剂量依赖的下调CYP11A1表达;在CYP11A1缺失的细胞中,青蒿素类衍生物不能进一步抑制雄激素合成,表明青蒿素通过抑制CYP11A1蛋白水平进而抑制雄激素合成。研究人员进一步发现,青蒿素类衍生物能够直接靶向并结合线粒体蛋白酶LONP1,发挥类似分子胶水的作用进而促进LONP1与CYP11A1的相互作用,增强LONP1降解CYP11A1。过表达LONP1能够模拟青蒿素类衍生物的作用,抑制雄激素的合成。
最后,研究人员开展了一项小型临床研究来评估青蒿素对PCOS患者的疗效,发现口服双氢青蒿素能够显著降低PCOS患者的血清雄激素水平,减少卵巢窦状卵泡数量,降低抗苗勒氏管激素(AMH)水平,并改善患者的月经周期。
综上所述,本项研究揭示了青蒿素治疗PCOS的潜在效果,鉴定了青蒿素诱导的LONP1-CYP11A1互作在PCOS治疗方面的应用价值,为临床治疗PCOS及雄激素升高相关疾病提供了新的思路。
Science同期发表了Elisabet Stener-Victorin教授(Karolinska Institutet)题为 Remedy hope for polycystic ovary syndrome 的专评,认为该研究为PCOS治疗提供了新的希望。

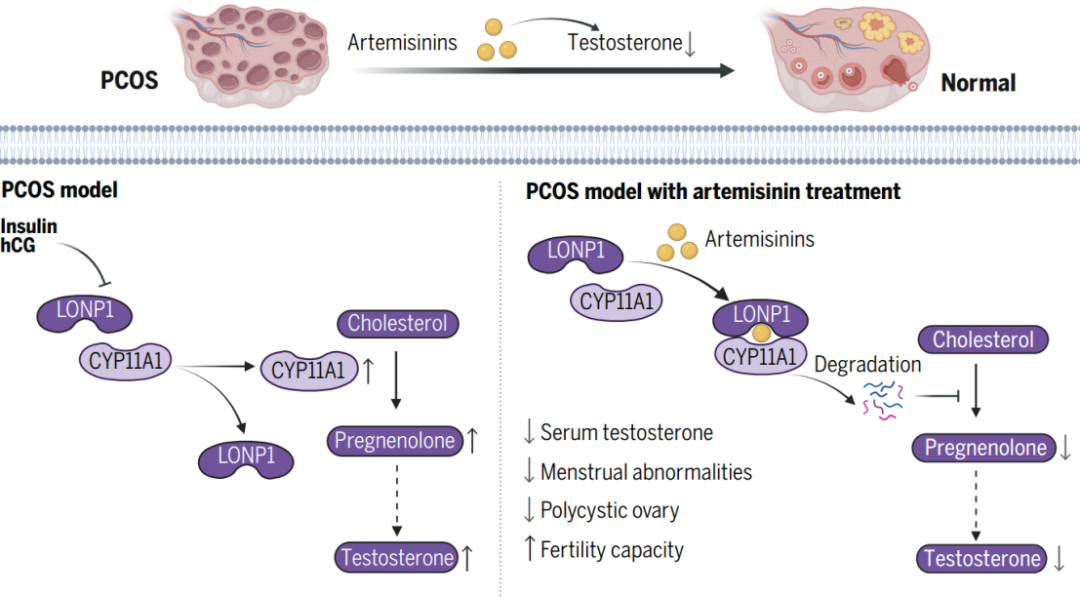
青蒿素类衍生物抑制PCOS发生的分子机制(Credit: Science)
参考文献:
1. M. O. Goodarzi, D. A. Dumesic, G. Chazenbalk, R. Azziz, Polycystic ovary syndrome: etiology, pathogenesis and diagnosis. Nat Rev Endocrinol 7, 219-231 (2011).
2. H. J. Teede et al., Recommendations From the 2023 International Evidence-based Guideline for the Assessment and Management of Polycystic Ovary Syndrome. J Clin Endocrinol Metab 108, 2447-2469 (2023).
3. Y. Tu, The discovery of artemisinin (qinghaosu) and gifts from Chinese medicine. Nat Med 17, 1217-1220 (2011).
4. P. Lu et al., Artemisinin derivatives prevent obesity by inducing browning of WAT and enhancing BAT function. Cell Res 26, 1169-1172 (2016).
5. Y. Chien, K. Rosal, B. C. Chung, Function of CYP11A1 in the mitochondria. Mol Cell Endocrinol 441, 55-61 (2017).
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


