Nat Genet:何厚胜/Ming Tsao合作揭示表观遗传调控因子MEN1在肿瘤及其微环境相互作用上的双重功能
来源:生物探索 2024-09-15 10:44
研究人员首次深入阐明了MEN1, MLL1与DNA结合的表观遗传学分子机理。基于这一机理,作者提出单独使用药物抑制MEN1或与免疫治疗联合可能会给实体瘤患者带来一种新的免疫治疗方法。
加拿大多伦多大学何厚胜团队以及Ming Tsao团队合作在Nature Genetics杂志上发表文章 In vivo CRISPR screens identify a dual function of MEN1 in regulating tumor-microenvironment interactions, 揭示了表观遗传调控因子MEN1在体内和体外不同的肿瘤微环境中功能的双重性,并为在实体瘤中靶向MEN1这个新的策略提供了理论和实验依据。

首先,为了找到作用于调节肿瘤微环境的表观遗传调控因子,作者利用肺癌细胞进行了同步的体外和体内(来源于相同细胞系的异种移植瘤)的CRISPR-Cas9 筛选。通过比较筛选结果,作者发现MEN1是具有差异性丢失效应的最高靶基因(图1)。进一步实验证实敲除MEN1不会影响在体外培养的细胞增殖,但在免疫缺陷或免疫正常的小鼠中MEN1的丢失会导致显著的促进或抑制肿瘤生长的双重效应,这体现出MEN1功能在体内作用的特殊性。为了找到MEN1功能背后的机制,作者对细胞系和小鼠肿瘤样本进行了RNA-seq测序,通过分析和比对发现,敲除MEN1后,细胞因子相关基因的表达最受影响。同样的结果也在其他的肺癌细胞系,患者源性肿瘤PDX模型还有TCGA相关数据库里得到证实。
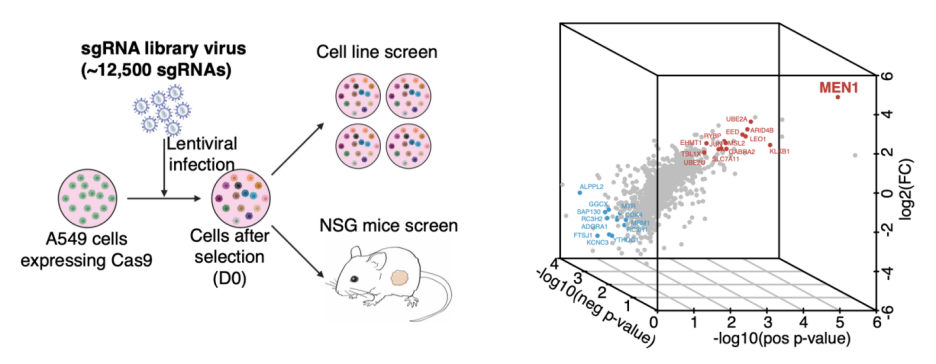
图1: 通过同步比较在二维细胞系培养中进行的靶向CRISPR-Cas9筛选与同一细胞系来源的异种移植体,发现了MEN1是体外和体内具有不同脱靶效应的最重要基因(Credit: Nature Genetics)
MEN1编码的menin蛋白是一种支架蛋白,不直接与DNA结合。MEN1 ChIP-seq和RNA-seq数据的联合分析结果也显示细胞因子相关基因的表达不直接受到MEN1的顺式调控。作者因此猜测MEN1可能是通过与其对应的辅因子蛋白MLL1的相互作用来进行表观遗传调控。为证实这一猜想,作者首先敲低了MLL1在相关细胞系的表达,发现先前看到的细胞因子的诱导被很大程度的削弱了。作者接下来再次进行了对MLL1 ChIP-seq的分析,发现MEN1缺失导致了MLL1与染色质结合位点的重新分布。
有趣的是,在新获得的增强结合位点中,大多数都含有重复元素(repetitive elements)。MLL1是一种特异性甲基转移酶,专门作用于H3K4。结合H3K4me3 ChIP-seq 和先前的RNA-seq数据,作者重新分析后发现MEN1缺失不仅增强了MLL1, H3K4me3在重复区域的结合而且激活了重复元素的转录。来自重复基因组区域的转录本倾向于形成双链RNA和诱导DNA损伤。这两点猜测均在后续的染色实验里得到了证实。先前有报道指出双链RNA可以通过RIG-1/MDA5-MAVS RNA感知通路或cGAS-cGAMP STING反转录DNA感知通路诱导病毒拟态反应。小鼠实验分析显示,在对照细胞中,MAVS或cGAS的敲除对肿瘤生长没有明显影响,但在MEN1敲除条件下显著减少了肿瘤生长的诱导。这些数据表明,MEN1通过依赖MAVS和cGAS/STING的病毒拟态机制调控细胞因子相关基因和肿瘤生长。
为了确定MEN1缺失如何调节肿瘤微环境(TME)细胞的浸润及其与肿瘤细胞的相互作用,作者在A549异种移植肿瘤的RNA-seq数据中鉴定了特异性映射到小鼠基因组的读取。差异基因和KEGG通路分析揭示,MEN1缺失肿瘤中上调的基因与白细胞功能相关的术语有显著富集。通路分析进一步显示,MEN1缺失条件下中性粒细胞这一白细胞亚型的功能被富集。为了验证患者肿瘤中的免疫细胞浸润,作者在肺腺癌组织微阵列中进行了中性粒细胞和CD8+ T细胞的IHC染色。MEN1表达较低的肿瘤确实表现出更强的中性粒细胞和CD8+ T细胞浸润。使用抗髓过氧化物酶的抗体中和中性粒细胞显著减轻了A549异种移植肿瘤中MEN1缺失诱导的肿瘤生长,这表明MEN1缺失促进肿瘤生长的作用依赖于中性粒细胞浸润。
使用TCGA数据集的全癌种分析揭示,“细胞因子-细胞因子受体相互作用”基因特征在26种癌症(亚)类型中的MEN1低表达患者中显著高于MEN1高表达患者。与A549肺癌细胞类似,在结肠癌细胞系HCT116中敲除MEN1在体外未改变细胞增殖,但显著增加了免疫缺陷NSG小鼠中的肿瘤生长。接下来,为了阐明MEN1缺失如何限制免疫能力完整的小鼠,作者将分析扩展到CT26小鼠结肠癌细胞系。通过对MEN1功能缺失的肿瘤进行的转录组分析发现,MEN1缺失肿瘤中抗病毒免疫反应通路的激活,表明肿瘤免疫原性增加。
为了系统地研究MEN1缺失对TME的影响,作者对在免疫功能完整小鼠中生长的对照和MEN1功能缺失的CT26肿瘤进行了单细胞RNA测序(scRNA-seq)和时间飞行质谱细胞计数(CyTOF)分析。这些数据表明,在MEN1缺失的肿瘤中,免疫细胞的总体百分比增加,除了CD45+细胞的总体增加外,免疫细胞的相对组成也发生了变化,其中CD8+ T细胞、树突状细胞和一个亚型的巨噬细胞显著富集。为了进一步验证MEN1缺失对CD8+ T细胞的影响,作者在拥有人类免疫系统的NSG小鼠中重建了A549异种移植肿瘤,并观察到MEN1缺失显著减少了肿瘤生长,与非人源化NSG小鼠中肿瘤生长增加的结果形成鲜明对比。
药物抑制MEN1-MLL相互作用在MLL1重排和NPM1突变白血病的预临床模型和临床试验中表现出有效性。为了评估抑制MEN1对实体瘤类型的疗效,作者使用临床阶段的MEN1抑制剂ziftomenib处理了CT26癌细胞。与MEN1缺失表型一致,作者观察到在ziftomenib处理后的CT26细胞中,细胞因子基因的诱导呈现剂量依赖性,验证了ziftomenib在这些细胞中的靶向效应。在免疫功能完整小鼠的同源4T1乳腺癌异种移植模型中,ziftomenib处理也表现出类似的生长抑制效果。此外,ziftomenib处理导致CD8+ T细胞浸润显著增加,且在更高剂量下观察到更强的诱导。中和CD8+ T完全消除了ziftomenib的肿瘤抑制效应,这表明MEN1对肿瘤生长的调控依赖于CD8+ T细胞。在后续的功能实验里,作者发现单独使用ziftomenib或抗PD-1治疗显著减少了CT26肿瘤生长,组合治疗表现出显著更强的效果。
在这篇文章中,研究人员首次深入阐明了MEN1, MLL1与DNA结合的表观遗传学分子机理。基于这一机理,作者提出单独使用药物抑制MEN1或与免疫治疗联合可能会给实体瘤患者带来一种新的免疫治疗方法(图2)。
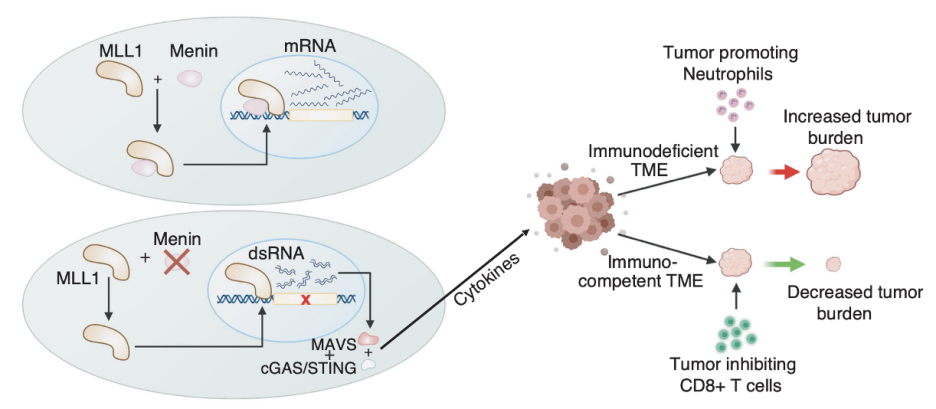
图2:模型总结MEN1在不同的肿瘤微环境中具有功能双重性的机理(Credit: Nature Genetics)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


